
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
A. 2.8 B. 18.8 C. 21.6 D. 29.16
科目:高中化学 来源: 题型:
【题目】下列物质中:①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;⑨CO2;⑩酒精溶液(均填写编号回答)
(1)pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是______.
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为______,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是__________.
(3)某温度时,1mol·L-1的醋酸溶液电离平衡常数为1.0×10-8,达平衡时,溶液中氢离子浓度是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中正确的是( )
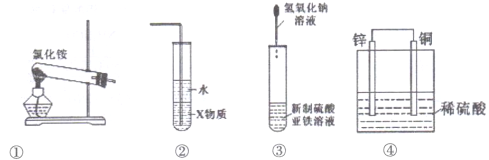
A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(Fe2O3)颜料的工艺流程如图所示。
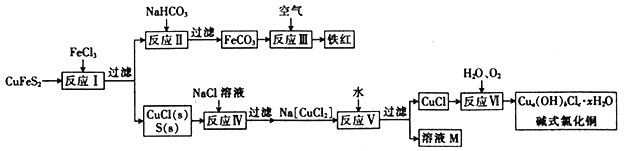
已知:a、b、c、x均为整数。
(1)该流程需进行多次过滤,过滤时用到的玻璃仪器为__________、__________和__________。
(2)反应Ⅰ的离子方程式为__________________,该反应的还原剂是__________(填化学式,下同),氧化产物是__________。
(3)反应Ⅱ的离子方程式为___________________________。
(4)反应Ⅵ是在45~50℃的条件下进行的,该反应中氧化剂与还原剂的物质的量之比为____________。
(5)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为_________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞内含有多种有机物,下图表示细胞内有机物的元素组成和功能的关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,x、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)I在小麦种子中主要是指____________,I在动物细胞中主要是指____________。若物质R与I具有相似功能,并且在动物、植物细胞均含有,不仅含能量多而且体积较小,则物质R是____________。
(2)与Y相比,Z特有的成分有____________。
(3)P通过____________反应形成Ⅳ,此过程生成的H2O中H原子来自P的____________(基团)。
(4)Ⅳ结构不同的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -25 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→ → →f→g→ → →d→e→j。(填仪器接口字母)_____________
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;__________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置A中导管m的作用是________________。
(4)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为______________。
(5)设计实验证明装置E中收集到的液体中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。A是所有元素中原子半径最小的元素。B、C、D同周期且相邻,C的气态氢化物的水溶液显碱性。E是同周期元素中金属性最强的元素。F的氧化物既能溶于强酸又能溶于强碱。G的一种氧化物能使品红溶液褪色,且G原子的M层电子数是K层电子数的3倍。按要求回答下列向题:
(1) C元素在周期表中位置_________;F原子的原子结构示意图是________。
(2)E与D形成的化合物E2D2的电子式是_______;B与D形成的化合物BD2的结构式是_____。
(3)B、G、H三种元素最高价氧化物的水化物的酸性从强到弱的顺序是________。E所在的周期中离子半径最小的是________。(用相应酸的化学式或离子符号回答问题)
(4)G的一种氧化物能使酸性高锰酸钾溶液褪色,对应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,现有浓度均为0.10 mol·L1的两种溶液:① 氨水、② 盐酸。请回答:
(1)溶液①的pH______13(填“>”、“<”或“=”)。
(2)两溶液等体积混合后所得溶液显酸性,原因是______(用离子方程式表示)。
(3)下列说法正确的是______(填字母)。
a.向①中滴加②,溶液的导电性增强
b.NH3·H2O和 HCl均能促进水的电离
c.若两溶液混合后pH = 7,则溶液中离子浓度存在关系:c(NH4+)= c(Cl-)> c(H+)= c(OH-)
(4)用石墨作电极电解盐酸时,阳极反应式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com