
【题目】下列有关烷烃的说法中,正确的是( )
A.戊烷的同分异构体有2种,其习惯命名分别为:正戊烷、异戊烷
B.沸点:正丁烷<异丁烷
C.符合通式CnH2n+2(n≥0)的物质一定是烷烃的同系物
D.随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,无限趋近于![]()
科目:高中化学 来源: 题型:
【题目】有容积相同的4个集气瓶,分别装满下列各气体,倒扣在盛水的水槽中,经充分反应后,集气瓶进水最多的是
A.NO和N2体积各占50%B.NO2和N2体积各占50%
C.NO2和O2体积各占50%D.NO和O2体积各占50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下, Al与Fe2O3发生铝热反应后得到的固体混合物中主要含有Al2O3、Fe,还含有少量Fe2O3。从该样品中固体混合物分离出Al2O3,并回收Fe和Fe2O3的流程如下:

已知:NaAlO2 + CO2 + 2H2O = Al(OH)3↓ + NaHCO3
回答下列问题:
(1)固体①的成分是__________。溶液②的溶质是____________。
(2)加入过量NaOH溶液时,发生反应的离子方程式是__________。
(3)白色固体②与NaOH溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
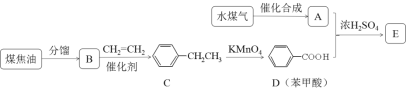
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扭曲烷( Twistane)是一种具有挥发性的环烷烃,其结构和球棍模型如图所示。下列说法正确的是( )

A.分子式为C10H18
B.与邻二乙苯互为同分异构体
C.分子结构中含有4个六元环
D.二氯代物多于3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少________?
(2)合金中镁铝的质量分数各是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g);ΔH=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_________
A.容器内压强不再发生变化B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为___________;反应放出的热量为_____kJ。
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______。
A.向容器中通入少量O2B.向容器中通入少量SO2C.使用催化剂D.降低温度E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图 B、F 元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出 C、N、O 三 种元素的相对位置。
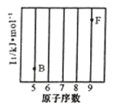
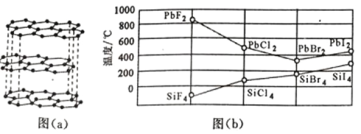
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_________________ 。
(3)二卤化铅 PbX2 的熔点如图(b)所示,可推断:依 F、Cl、Br、I 次序,PbX2 中的化学键 的离子性_____( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性_____。
(4)NH3 和 F2 在 Cu 催化下可发生反应 4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3 与一定量水形成(H2O)2·BF3 晶体 Q,Q 在一定条件下可转化为 R: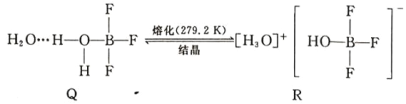 晶体 R 中含有的化学键包 括_____。
晶体 R 中含有的化学键包 括_____。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的 Ka2____________________________苯酚
,相同温度下,水杨酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
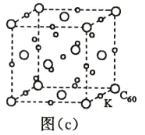
(7)碳的另一种单质 C60 可以与钾形成低温超导化合物,晶体结构如图(c)所示,K 位于立方体的棱上和 立方体的内部,此化合物的化学式为____________;其晶胞参数为 1.4 nm,阿伏加德罗常数用 NA 表 示,则晶体的密度为________________g·cm-3。(只需列出式子)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com