
����Ŀ��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ��;��
��1�����̼�Ȼ�ԭ����������ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g�� ��H=akJ��mol-1
3AlCl��g���T2Al��l��+AlCl3��g�� ��H=bkJ��mol-1
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=__________kJ��mol-1���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H=Q kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H=Q kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�

��0��10min�ڣ�NO��ƽ����Ӧ����v(NO)�� ��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K�� ��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������ (����ĸ���)��
a��ͨ��һ������NO
b��ͨ��һ������N2
c���ʵ����߷�Ӧ��ϵ���¶�
d��������ʵĴ���
e���ʵ���С���������
���ں��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬�������� (��ѡ����)��
A����λʱ��������2nmolNO(g)��ͬʱ����nmolCO2(g)
b����Ӧ��ϵ��ѹǿ���ٷ����ı�
C�����������ܶ���������
d����������ƽ����Է���������������
����������������Ӧǰ3Omin�ķ�Ӧ�������䣬��ʼʱNO��Ũ��Ϊ2.50mol/L����Ӧ��ƽ��ʱc(NO)=____ _____mol/L��NO��ת����_________������������������С����������������
��3�������������Խ��,Al-Ag2O��ؿ�����ˮ�¶�����Դ����ԭ����ͼ��ʾ

��д���õ��������Ӧʽ___________�������£��øû�ѧ��Դ�Ͷ��Ե缫���300mL����ͭ��Һ��������������27mgAl���������Һ��pH=___________����������Һ����ı仯����
���𰸡���1��0.5a+b��
��2����0.032mol/(Lmin����0.25����ae����cd����1.25mol/L������
��3��Ag2O��2e����H2O��2Ag��2OH����2��
��������
�����������1����a��2Al2O3��s��+2AlCl3��g��+6C��s���T6AlCl��g��+6CO��g����H=a kJmol-1b��3AlCl��g���T2Al��l��+AlCl3��g����H=b kJmol-1�����ݸ�˹����a��2+b�õ���Al2O3��s��+3C��s���T2Al��l��+3CO��g����H=0.5a+bKJ/mol���ʴ�Ϊ��0.5a+b����2����0��10min�ڣ� v��NO��= (1.00-0.68 )/10=0.032molL-1min-1��C��s��+2NO��g��N2��g��+CO2��g����ƽ��Ũ��c��N2��=0.25mol/L��c��CO2��=0.25mol/L��c��NO��=0.5mol/L����Ӧ��ƽ�ⳣ��K= C(N2)C(CO2)/C2(NO)=(0.25��0.25)/0.52=0.25;�ʴ�Ϊ��0.032molL-1min-1��0.25����30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬C��s��+2NO��g��N2��g��+CO2��g��������ͼ�����ݷ�����ƽ��״̬����Ũ����������ƽ�ⳣ������K= C(N2)C(CO)/C2(NO)=(0.3��0.3)/0.62=0.25,ƽ�ⳣ�����¶ȱ仯��ƽ�ⳣ������˵���ı������һ�������¶ȣ��������ݷ�����C(N2)��������̼��һ������Ũ������Ӧǰ������������䣬���Կ����Ǽ�С��Һ��������һ����һ�������� a��ͨ��һ������NO����ƽ��״̬������ƽ��Ũ������a��ȷ�� b������һ�����Ļ���̿��̼�ǹ����ƽ����Ӱ�죬ƽ�ⲻ������b���� c��������ʵĴ���������ֻ�ı仯ѧ��Ӧ���ʣ����ı仯ѧƽ�⣬��C���� d���ʵ���С�������������Ӧǰ��������䣬ƽ��״̬����Ũ������d���ʴ�Ϊ��ad������30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1��ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ�����ȷ�Ӧ��������Ӧ�Ƿ��ȷ�Ӧ����ѡ�����ʴ�Ϊ������ ��T�� V���䣬 a�����۷�Ӧ�Ƿ�ﵽƽ��״̬����λʱ��������2n mol NO��g����ͬʱ����n mol CO2��g������a���� b����H<0�����Է�Ӧ��ϵ���¶����ŷ�Ӧ���ƶ����ı䣬��ƽ��ʱ����Ӧ��ϵ���¶Ȳ��䣬��b��ȷ�� C����Ӧ���й���μӣ���Ӧǰ��������������ȣ����Ե���Ӧ�ﵽƽ��ʱ�����������ܶȲ��ٱ仯����c��ȷ�� d�����۷�Ӧ�Ƿ�ﵽƽ��״̬��ѹǿʼ�ղ��䣬��d���ʴ�Ϊ��bc����3��������Ag2O�õ��Ӻ�ˮ��Ӧ����Ag��OH-���缫��ӦʽΪ��Ag 2O+2e-+H2O=2Ag+2OH-�����ݷ�Ӧ�е�ʧ��������ȼ��㣬����27mg Alʧȥ����0.003mol������ҪOH-�����ʵ���=0.003mol����Һ������H+����Ϊ0.003mol������ҺC(H+)= 0.003/0.3=0.01 mol/L��PH=-lg0.01=2���ʴ𰸣�Ag2O+2e-+H2O=2Ag+2OH-��2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ����������
B. �ӵ�ʳ�κ��е����(KIO3)
C. ����������Ԫ�ؾ���ά����
D. ����������Ԫ�ز����ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽������У����е����� ��
A. ��ϡ�������ˣ���ȥ����ͭ���е�����þ�ۺ�����
B. ����ȡ�ķ����������ͺ�ú��
C. ���ܽ⡢���˵ķ�������KNO3��NaCl����Ļ����
D. ��O2��H2�Ļ������ͨ�����ȵ�����ͭ���Գ�ȥ���е�H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤�������Ѿ���ȫˮ����Լ���( )
A���⻯����Һ B��������Һ C����ˮ D����̪�Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǰ���![]() ����һ�ֻ�ԭ��������
����һ�ֻ�ԭ��������![]() ���ǰ���������Һ��������
���ǰ���������Һ��������![]() ��Һ����������·�Ӧ������
��Һ����������·�Ӧ������![]() ����ǡ����
����ǡ����![]()
![]() ������
������![]() ��Һ��ȫ��������
��Һ��ȫ��������![]() ��
��![]() �����ʣ���������Ӧ���ǰ�������������
�����ʣ���������Ӧ���ǰ�������������
A��![]() B��
B��![]() C��NO D��
C��NO D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ��գ�
��1��0.3molNH3��������������______gH2O������������������ȡ�
��2����״���£�2.4gij���������Ϊ672mL������������Է�������Ϊ__________��
��3��ij�λ����Һ�к���������Na+��Mg2+�� Cl-��SO42-�����Na+��Mg2+��C1-�����ʵ���Ũ������Ϊ:0.2mol/L��0.25mol/L��0.4mol/L�����c(SO42-��=__________��
��4����֪���ӷ�Ӧ��RO33-+6I-+6H+=R-+3I2+3H2O,�Ը������ӷ���ʽ�����������غ�������غ������ж���n=___________��RԪ������RO33-�Ļ��ϼ���_____________��
��5��ͬ��ͬѹ�£�SO2��O2���ܶ�֮��Ϊ___________����������ͬ����������������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ�������к�������Ԫ�غ������������������Ԫ�طֱ���
A��C��O B��C��C C��O��C D��O��N
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���е����ߣ�������Ϊ���������������������Ϊ�������ʵ����������д������
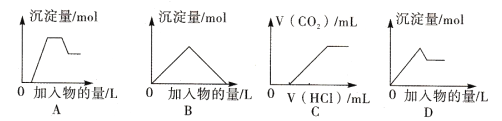
A. ͼA��ʾ��H+��Mg2+��Al3+��NH4+����Һ�еμ�NaOH��Һ�����������Ĺ�ϵ����
B. ͼB��ʾ�����ʯ��ˮ��ͨ�������ֱ̼�����������������Ĺ�ϵ����
C. ͼC��ʾ��NaOH��Na2CO3�Ļ��Һ�еμ��������CO2����Ĺ�ϵ����
D. ͼD��ʾ��������Һ�еμ�Ba��OH��2��Һ�����������Ĺ�ϵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ba��OH��2��Һ����μ���ϡ���ᣬ������������⣺
��1��д���÷�Ӧ�����ӷ���ʽ��______________��
��2��������������£����ӷ���ʽ����1����ͬ���������������
A����NaHSO4��Һ����μ���Ba��OH��2��Һ����Һ������
B����NaHSO4��Һ����μ���Ba��OH��2��Һ��SO42��ǡ����ȫ����
C����NaHSO4��Һ����μ���Ba��OH��2��Һ������
��3����Ba��OH��2��Һ�л�������ϡ����ֱ�����������������л����Һ�ĵ����������õ���ǿ��I��ʾ���ɽ��Ƶ�������ͼ1�е�_________������������߱�ʾ��
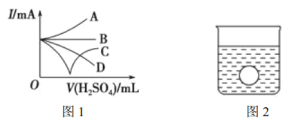
��4������һ����⻬������С��������Ba��OH��2��Һ���룬����ͼ2��ʾ������ձ��л���ע����Ba��OH��2��Һ���ܶȵ�ϡ������ǡ����ȫ��Ӧ���ڴ�ʵ������У�С��__________����������������½������ֲ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com