
【题目】根据所学知识填空:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)标准状况下,2.4g某气体的体枳为672mL,则此气体的相对分子质量为__________。
(3)某盐混合溶液中含有离子:Na+、Mg2+、 Cl-、SO42-,测得Na+、Mg2+和C1-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,测得c(SO42-)=__________。
(4)己知离子反应:RO33-+6I-+6H+=R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=___________,R元素在中RO33-的化合价是_____________。
(5)同温同压下,SO2与O2的密度之比为___________,若质量相同,两种气体的体积比为__________。
【答案】
(1)5.4g
(2)80
(3)0.15mol/L
(4)1;+5。
(5)2:1;1:2
【解析】
试题分析:(1)0.3molNH3含有的质子数的物质的量为0.3mol×(7+3)=3mol,而1molH2O含有(2×1+8)mol=10mol质子,则应有0.3molH2O,质量为m(H2O)=0.3mol×18g/mol=5.4g,故答案为:5.4g;
(2)n=0.672L/22.4L/mol=0.03mol,M=m/n=2.4g/0.03mol=80g/mol,则相对分子质量为80,故答案为:80;
(3)根据电荷守恒得c(SO42-)=![]() =
=![]() mol/L=0.15 molL-1,故答案为:0.15 molL-1;
mol/L=0.15 molL-1,故答案为:0.15 molL-1;
(4)由电荷守恒可知反应RO3n-+6I-+6H+═R-+3I2+3H2O中,n=1,则RO3-中R的化合价为+5价,故答案为:1;+5;
(5)同温同压下,气体的密度之比等于相对分子质量之比,SO2与O2的密度之比为64:32=2:1,同温同压下,气体的体积之比等于物质的量之比,质量相同,两种气体的体积比为![]() :
:![]() =1:2,故答案为:2:1;1:2。
=1:2,故答案为:2:1;1:2。


科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
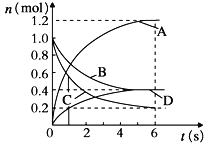
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的核心是在化学反应过程中或化工生产中,尽量减少使用或彻底消除有害物质,下列做法中,符合“绿色化学”理念的是 ( )
A.生产和使用剧毒农药 B.化工厂产生的废气向高空排放
C.利用氢气作高能燃料 D.造纸厂用二氧化硫进行纸浆漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在标准状况下,22.4LCCl4中含5 NA 个原子
B.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA
C.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA
D.将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:

①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO
b.通入一定量的N2
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
C.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=____ _____mol/L。NO的转化率_________(填“增大”、“减小”或“不变”)。
(3)铝电池性能优越,,Al-Ag2O电池可用作水下动力电源,其原理如图所示

请写出该电池正极反应式___________;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=___________(不考虑溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)检验某溶液中是否含SO42-的正确操作顺序是:取少量未知溶液,加入____________________,若出现 现象,再加入_____________,若出现 现象,证明原溶液含有SO42-;BaSO4和NaCl的悬浊液在分离过程中涉及到过滤、洗涤沉淀操作,证明滤纸上的BaSO4沉淀已经洗净的方法是_______________。
(Ⅱ)现有A、B两种有机物的液体混合物,如果A、B互溶,且相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
(1)分离上述A、B的混合物,常用的方法是 ,需要的玻璃仪器有酒精灯、温度计、牛角管、蒸馏烧瓶,还有 和 (每空1分)。
(2)应用上述分离操作,首先得到的物质是 。
(3)点燃酒精灯前的最近一步操作是 。
(Ⅲ)下图是硫酸试剂瓶标签上的内容:
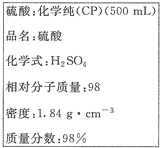
(1)该硫酸的物质的量浓度是 mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则需要取 mL的该硫酸。将上述硫酸进行稀释的实验操作为 。
(3)用上述硫酸配制240 mL 4.6 mol·L-1的稀硫酸,实验仪器有:
①50 mL量筒 ②100 mL量筒 ③托盘天平 ④玻璃棒
⑤250 mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时使用选用仪器的先后顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,已知Cu3P中P为-3价,则15molCuSO4可氧化的P的物质的量为
A. 1.5mol B. 5.5mol C. 3mol D. 2.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH标准溶液的配制和标定时,需经过NaOH溶液的配制、基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列操作正确的是( )
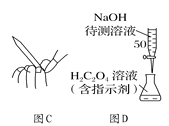
A. 用图A所示的方法转移NaOH溶液到容量瓶中
B. 用图B所示的装置准确称得0.15 g H2C2O4·2H2O
C. 用图C所示的操作排除碱式滴定管中的气泡
D. 用图D所示的装置,用NaOH待测液滴定H2C2O4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示。
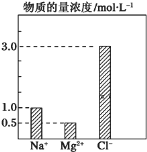
回答下列问题:
(1)该混合液中,NaCl的物质的量为 ,含溶质MgCl2的质量为 ;
(2)该混合液中,CaCl2的物质的量为 ,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 ;
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com