
����Ŀ����I������ij��Һ���Ƿ�SO42-����ȷ����˳���ǣ�ȡ����δ֪��Һ������____________________�������� �����ټ���_____________�������� ����֤��ԭ��Һ����SO42-��BaSO4��NaCl������Һ�ڷ���������漰�����ˡ�ϴ�ӳ���������֤����ֽ�ϵ�BaSO4�����Ѿ�ϴ���ķ�����_______________��
����������A��B�����л����Һ��������A��B���ܣ������������ѧ��Ӧ���ڳ�ѹ�£�A�ķе�Ϊ35����B�ķе�Ϊ200�����ش��������⣺
��1����������A��B�Ļ������õķ����� ����Ҫ�IJ��������оƾ��ơ��¶ȼơ�ţ�ǹܡ�������ƿ������ �� ��ÿ��1�֣���
��2��Ӧ������������������ȵõ��������� ��
��3����ȼ�ƾ���ǰ�����һ�������� ��
��������ͼ�������Լ�ƿ��ǩ�ϵ����ݣ�
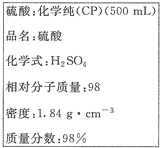
��1������������ʵ���Ũ���� mol��L-1��
��2��ij��ѧ��ȤС������������ʵ�ʵ��̽��ʱ����Ҫ240 mL 4.6 mol��L-1��ϡ���ᣬ����Ҫȡ mL�ĸ����ᡣ�������������ϡ�͵�ʵ�����Ϊ ��
��3����������������240 mL 4.6 mol��L-1��ϡ���ᣬʵ�������У�
��50 mL��Ͳ ��100 mL��Ͳ ��������ƽ ��������
��250 mL����ƿ ����ͷ�ι� ���ձ� ����ƿ
ʵ��ʱʹ��ѡ���������Ⱥ�˳��Ϊ ��
���𰸡���I��ϡ��������������ټ�BaCl2��Һ����ɫ������ȡ���һ��ϴ��Һ������AgNO3��Һ�ް�ɫ��������
��������1�����������ܣ���ƿ��2��A��3��ͨ��ˮ
��������1��18.4��2��62.5������ȡ��Ũ�����������ڻ������뵽ʢ������ˮ���ձ��У����ò��������Ͻ��� ��3���ڢܢߢݢ����ڢߢܢݢ�
�������������������I������ij��Һ���Ƿ�SO42-����ȷ����˳���ǣ�ȡ����δ֪��Һ������ϡ���ᣬ����������������Ȼ���ټ����Ȼ�����Һ��������ְ�ɫ��������֤��ԭ��Һ����SO42-����Һ�к��������ӣ���֤����ֽ�ϵ�BaSO4�����Ѿ�ϴ���ķ������Ǿ���ϴ��Һ��û�������ӣ�������Ϊȡ���һ��ϴ��Һ������AgNO3��Һ�ް�ɫ����������
����������A��B�����л����Һ��������A��B���ܣ������������ѧ��Ӧ���ڳ�ѹ�£�A�ķе�Ϊ35����B�ķе�Ϊ200�����ش��������⣺
��1��A��B�����л����Һ�����ﻥ�ܣ����е����ϴ���˷�������A��B�Ļ������õķ�����������Ҫ�IJ��������оƾ��ơ��¶ȼơ�ţ�ǹܡ�������ƿ�����������ܺ���ƿ��
��2��Ӧ������������������ȵõ��������Ƿе��С��A���ʡ�
��3����ȼ�ƾ���ǰ�����һ��������ͨ��ˮ��
��������1�����������Ϣ֪��������ܶ�Ϊ1.84g/cm3����������Ϊ98%�����ݹ�ʽ![]() ����ø���������ʵ���Ũ��Ϊ18.4mol/L ��
����ø���������ʵ���Ũ��Ϊ18.4mol/L ��
��2������240mL4.6 mol��L-1��ϡ��������250mL������ƿ�����ݹ�ʽc1V1=c2V2����V2= c1V1/c2=��250��4.6��/18.4=62.5mL��Ũ��������ˮ���ȣ����ܶȴ���ˮ�����ϡ��Ũ����IJ����ǽ���ȡ��Ũ�����������ڻ������뵽ʢ������ˮ���ձ��У����ò��������Ͻ��裻
��3����ʵ���ʵ�鲽��Ϊ�����㡢�������ܽⲢȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȡ�����ʵ�鲽��ȷ��ʵ�����������ʵ�鲽�谴ʵ������Ⱥ��������Ϊ�ڢܢߢݢ����ڢߢܢݢ���


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ̽��ѧϰС��ͬѧ�ú���������������ҪΪ������ɳ��CaCl2��MgCl2��Na2SO4�����Ĵ�����ȡ����ѧ��������NaCl��ʵ��ǰ������������·�������ͼ����

��1����д�������ڢܡ��ݲ������Լ����Ƽ��ڢ��������ƣ�
��_________����_________����_________��
��2��д���ڢݲ������п��ܷ�����Ӧ�Ļ�ѧ����ʽ��________________________��
��3����������������ڢݲ�ʵ���Ƿ�ﵽ��Ŀ�ģ�________________________��
��4������Ϊ���������Щ���������Ӱ��ʵ������____________________________��
��5����ͬѧ��Ϊ����ʵ����Ʋ�����Լ����������һ�����룺_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
��1������֮��Ϊ96����O2��O3�������ϣ�����ԭ�Ӹ���Ϊ______________��
��2����Ҫ����1 mol��L1 Na2CO3��Һ250 mL��������Ҫ����Na2CO3_____________g������Ҫ���ᾧˮ��̼���ƾ��壨Na2CO3��10 H2O�� g������Ҫ���ʵ���Ũ��Ϊ4 mol��L1��Na2CO3��Һ mL������Ҫ���ʵ���������Ϊ12�����ܶ�Ϊ1��12 g��cm-3��Na2CO3��Һ mL��
��3��������������Һ�Ĺ����У����ܵ���������ҺŨ��ƫС���У�_________
A. ����Na2CO3�������̣�1 g���������룩��
B. ����ƿ��̼������Һ����ϴ��
C. ת����Һʱδϴ���ձ���
D. ����ʱ����Һδ��ȴ��
E. ����ʱ�������ӣ�
F. ҡ��ʱ������Һ���������ƿ�̶��ߣ���δ����ˮ��
G. ����ƿδ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A��pH=l����Һ�У�CH3CH2OH��Cr2O72����K+��SO42��
B��NaHCO3��Һ����![]() ��CO32����Br����K��
��CO32����Br����K��
C���������۷ų�����H2����Һ�У�Fe2+��K+��Cl����NO3��
D��C��Ca2+��=0.1 mol��L��1����Һ�У�NH4+��SO42-��CH3COO����Br-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ��գ�
��1��0.3molNH3��������������______gH2O������������������ȡ�
��2����״���£�2.4gij���������Ϊ672mL������������Է�������Ϊ__________��
��3��ij�λ����Һ�к���������Na+��Mg2+�� Cl-��SO42-�����Na+��Mg2+��C1-�����ʵ���Ũ������Ϊ:0.2mol/L��0.25mol/L��0.4mol/L�����c(SO42-��=__________��
��4����֪���ӷ�Ӧ��RO33-+6I-+6H+=R-+3I2+3H2O,�Ը������ӷ���ʽ�����������غ�������غ������ж���n=___________��RԪ������RO33-�Ļ��ϼ���_____________��
��5��ͬ��ͬѹ�£�SO2��O2���ܶ�֮��Ϊ___________����������ͬ����������������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S������Դ������;��֮һ�ǻ����������õ�������Ӧԭ��Ϊ��2H2S(g) + O2(g) = S2(s) + 2H2O(l) ��H=��632kJ��mol��1����ͼΪ����ĤH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ����

A. �缫aΪ��ص�����
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2+2H2O+4e![]() =" 4" OH
=" 4" OH![]()
C. ��·��ÿ����4mol���ӣ�����ڲ��ͷ�632kJ����
D. ÿ17gH2S���뷴Ӧ����1mol H+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ���ܵ����Cl-����
A. HCl B. NaClO C. MgCl2 D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A. �ڻ���������Ӧ��ѭ����ɫ��ѧ����˼��
B. �ڹ���Ԫ����Ѱ�������Ĵ���
C. ��Ԫ�����ڱ��Ľ����ͷǽ����ֽ��߸���Ѱ�Ұ뵼�����
D. ����Ԫ�������ɣ���HC1O4�������Ƴ���Ԫ��Ҳ��������������ˮ����HFO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ϸ����Ԫ���뻯�����˵��������ȷ���ǣ� ��
A. ���ϸ���ij�����Ԫ����20���֣�����̼Ԫ���������Ԫ��
B. ˮ�ǻ�ϸ���к������Ļ������ijЩ���ﻯѧ��Ӧ��ԭ��
C. �ߵ�ֲ��ϸ������ɳɷֶ�������ά�غ���
D. ϸ���е�������Ҫ�Ի��������ʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com