
����Ŀ����1��1mol H2SO4�к���_____����ԭ�ӣ�_____mol O��
��2��д������������ˮ��Һ�еĵ��뷽��ʽ
HCl��_______________NaHSO4��____________________
��3��д�����л�ѧ��Ӧ�ķ���ʽ
��������й��������������̼��Ӧ�Ļ�ѧ����ʽ_________________
������������ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ�ķ�Ӧ�Ļ�ѧ����ʽ____________________
ӡˢ��·�崦��ʱͭ���Ȼ�����Һ��Ӧ�����ӷ���ʽ_______________________
��4����ƽ���з���ʽ��
_____I��+_____IO3��+ _____H+��_____I2+_____H2O
_____NH4ClO4����_____N2��+_____O2��+_____HCl+_____H2O
��5���õ����ŷ���˫���ŷ���ʾ�÷�Ӧת�Ƶ��ӵķ������Ŀ����գ�
Cu��4 HNO3��Ũ��= Cu(NO3)2�� 2 NO2���� 2H2O__________________
HNO3��������__________������������Ӧ������������__________��
���𰸡�NA 4 HCl=H����Cl�� NaHSO4 = Na+ + H++SO42- 2Na2O2+2CO2=2Na2CO3+O2 4Fe(OH)2+O2+2H2O��4Fe(OH)3 2Fe3+��Cu=2Fe2+��Cu2+ 5 1 6 3 3 4 2 5 4 6 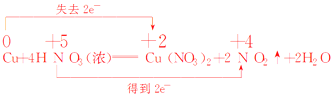
![]() �����Ժ����� Cu(NO3)2
�����Ժ����� Cu(NO3)2
��������
��1���������ʽṹ���м��㣻
��2��ǿ�������ȫ���룻
��3�����������������̼��Ӧ����̼���ƺ�������������������ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫΪ������������������ˮ��Ӧ��������������ͭ���Ȼ�����Һ��Ӧ�����������Ӻ�ͭ���ӣ�
��4�����ݻ��ϼ������������ϼ�ֻ��£���ཻ��ԭ����ƽ��
��5����ԭ����ʧ���ӣ����ϼ����ߣ�����������Ӧ������Ϊ��������������õ��ӣ����ϼ۽��ͣ�����Ϊ��ԭ���
��1��һ��H2SO4�����к���1��Sԭ�ӣ�4��Oԭ�ӣ���1mol H2SO4�к���NA����ԭ�ӣ�4mol O��
��2��HClΪǿ����ʣ���ˮ����ȫ���룬���������Ӻ������ӣ�����뷽��ʽΪ��HCl=H����Cl���� NaHSO4Ϊǿ����ʣ���ˮ����ȫ���룬���������ӡ������Ӻ���������ӣ�����뷽��ʽΪ��NaHSO4 = Na+ + H++SO42-��
��3�����������������̼��Ӧ����̼���ƺ�����������ʽΪ2Na2O2+2CO2=2Na2CO3+O2��������������ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫΪ������������������ˮ��Ӧ������������������ʽΪ4Fe(OH)2+O2+2H2O��4Fe(OH)3��ͭ���Ȼ�����Һ��Ӧ�����������Ӻ�ͭ���ӣ����ӷ���ʽΪ2Fe3+��Cu=2Fe2+��Cu2+��
��4������������ԭ��Ӧ�У����ϼ�ֻ��£���ཻ��ԭ�����ӱ�Ϊ0�ۣ���������ӱ�Ϊ0�ۣ�����С������Ϊ5�������ӷ���ʽΪ5 I��+IO3��+ 6H+=3I2+3H2O��
���������������������ԭ��Ӧ��N��O�Ļ��ϼ����ߣ�Cl�Ļ��ϼ۽��ͣ����ݵ��ӵ�ʧ�غ㣬��4NH4ClO4=2N2��+5O2��+4HCl+6H2O��
��5����Ӧ��Cu����ԭ����ʧ���ӣ����ϼ���0�۱�Ϊ+2�ۣ����ɵIJ���Ϊ����������������������ᣬ����N�õ��ӻ��ϼ۽�����+5��Ϊ+4�����ɵIJ���Ϊ��ԭ���˫���ŷ���ʾΪ �������ŷ�Ϊ
�������ŷ�Ϊ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3-���ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3-�ķ�Ӧԭ����ͼ��ʾ��
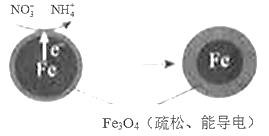
����������������____��
�������ĵ缫��Ӧʽ��____��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3-��ȥ���ʵ͡���ԭ����____��
��4�����������루2����ͬ����1Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3-ȥ���ʺ���������������̬��ͬ��ԭ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ҵ�ϣ���Cu2O/ZnO �������������·�����Ӧ��CO(g)+2H2(g)CH3OH(g) ��H
��1����֪��CH3OH(l)=CH3OH(g) ��H=+35.2kJmol-1�����ݱ���
���� | H2(g) | CO(g) | CH3OH(l) |
ȼ����/kJmol-1 | -285.8 | -283.0 | -726.5 |
��ӦCO(g)+2H2(g)CH3OH(g) ��H=______kJmol-1
��2����2L�����ܱ�������ͨ��1mol CO(g)��2mol H2(g)��������Ӧ�ϳɼ״�����Ӧ������n(CH3OH)��ʱ��(t)���¶ȵĹ�ϵ��ͼ1��ʾ����500���ѹ�����£�����ͼ1�л�����Ӧ��ϵ��n(CH3OH)��ʱ�䣨t���仯������ͼ��
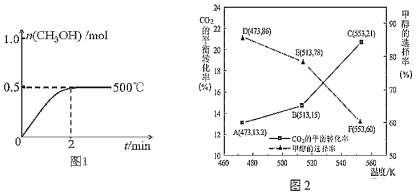 ____________
____________
�������״�������CO2��H2�ڴ���CZZA����ͨͭ�������������ºϳɣ���ط�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H1=-49.2kJmol-1
��Ӧ��CO2(g)+H2(g)CO(g)+H2O(g) ��H2=41.2kJmol-1
��3����CZZA/rGOΪ��������һ�������£���1mol CO2��3mol H2ͨ������ܱ������н��з�ӦI�ͷ�ӦII��CO2��ƽ��ת���ʺͼ״���ѡ���ʣ��״���ѡ���ʣ�ת����CO2�����ɼ״������ʵ������������¶ȵı仯������ͼ2��ʾ��
����553Kʱ����Ӧ��ϵ��CO�����ʵ���Ϊ______ mol
�������¶ȵ����ߣ�CO2��ƽ��ת�������ӵ��״���ѡ���ʽ��ͣ��������ԭ��______
��������4����ͼΪ�ȼҵ��װ��ʾ��ͼ��a�˽��������Ϊ______����ҵ�ϻ��������ø�װ�ã����ļ��Ȼ��[(CH3)4NCl]ˮ��ҺΪԭ�ϣ�ͨ����ⷨ���Ʊ��ļ��������[(CH3)4NOH]�����ռ���(CH3)4NOH��������______����a��b��c��d����
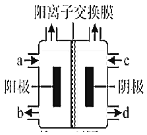
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�е�ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D | |
ʵ�鷽�� |
|
|
|
|
ʵ�� Ŀ�� | ��֤FeCl3��H2O2�ֽⷴӦ�д����� | �Ƚ�HCl��H2CO3��H2SiO3������ǿ�� | ��ȥSO2�е�����HCl | ȷ��ȡ20.00mL���K2Cr2O7����Һ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���ͺ����к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
ij��ѧ��ȤС�齫�������̢�������Ƴ�����ͼ��ʾ������
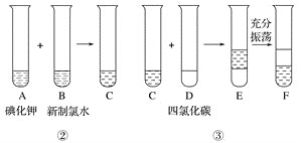
��֪���̢ڷ�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI===2KCl��I2
�ش��������⣺
��1��д����ȡ���̢�������ʵ����������ƣ���____________����____________��
��2�������չ����У�ʹ�õ���ʵ�������оƾ��ơ�____________��____________(����������)��
��3��F���²�Һ�����ɫΪ________ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�Ϊ____________��
��4����F�еõ���̬�����еIJ�����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C�����ֳ����Ļ����AΪ����ɫ���壬����һ�ֽ������ʡ�����֮���ת����ϵ��ͼ��ʾ��������пհף�
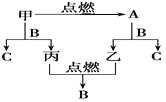
(1)A�Ļ�ѧʽ��________��B�Ļ�ѧʽ��________��
(2)д���ף�B��Ӧ����C�����Ļ�ѧ����ʽ��_______________________________
(3)д��A��һ����Ҫ��;��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���磭Fenton��������ˮ�����л���Ⱦ�オ��ĸ�������������Ӧԭ����ͼ��ʾ����������H2O2��Fe2+������Ӧ���ɵ��ǻ����ɻ�����OH�������������л���Ⱦ�����˵���������
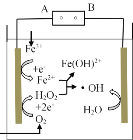
A.��Դ��A��Ϊ����
B.���ԴB�������缫�ĵ缫��ӦʽΪH2O��e- ��H+����OH
C.Fenton��ӦΪ��H2O2��Fe2+��Fe(OH)2+����OH
D.ÿ����2.24LO2����״���������������������Ͽɲ�������OHΪ0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʴ�йص�˵����ȷ���ǣ�������
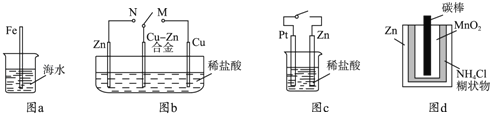
A.ͼa�У����뺣ˮ�е�������Խ�����˸�ʴԽ����
B.ͼb�У�������M������Nʱ��Cu��Zn�Ͻ�ĸ�ʴ���ʼ�С
C.ͼc�У���ͨ����ʱZn��ʴ��������Zn�Ϸų����������Ҳ����
D.ͼd�У�Zn��MnO2�ɵ���Էŵ縯ʴ��Ҫ����MnO2���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1 mol��L-1 NaOH��Һ450mL��0.5 mol��L-1������Һ500mL��������������Һ����������ش��������⣺
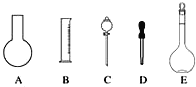
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����_______������ţ�������������Һ�����õ��IJ���������_________�����������ƣ���
��2��������NaOH��Һʱ��
�����ݼ�����������ƽ��ȡNaOH������Ϊ______g��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��_____������ƫ��������ƫ������������������
����NaOH�����ܽ��������������ƿ��ϴ���ձ���ϴ��Һ��������ƿ�����ݣ���������ҺŨ��________������ƫ��������ƫ������������������
��3��������������Һʱ��
������ȡ��������Ϊ98%���ܶ�Ϊ1.84 g��cm-3��Ũ��������_______ml;
��������������Һʱ�������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ�IJ���������_________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com