
【题目】下列与金属腐蚀有关的说法正确的是( )
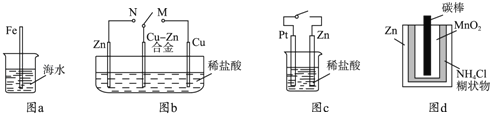
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要 240mL 1 mol· L-1 的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用 的仪器有:① 胶头滴管;②玻璃棒;③烧杯;④量筒。 请回答下列问题:

(1)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(2)该硫酸的物质的量浓度为__________ mol/L;所需浓硫酸的体积约为_______mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数_______49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是_________________
(4)下列操作对 H2SO4 的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:_________________ ;
②量筒量取液体药品时仰视读数:_____________ ;
③未等溶液冷却就定容:_____________ 。
(5)在配制过程中,下列操作不正确的是(填序号) _____________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的 18.4mol·L-1 的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含有_____个硫原子,_____mol O。
(2)写出下列物质在水溶液中的电离方程式
HCl:_______________NaHSO4:____________________
(3)写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式_________________
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式____________________
印刷电路板处理时铜与氯化铁溶液反应的离子方程式_______________________
(4)配平下列方程式:
_____I-+_____IO3-+ _____H+—_____I2+_____H2O
_____NH4ClO4——_____N2↑+_____O2↑+_____HCl+_____H2O
(5)用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O__________________
HNO3的作用是__________,发生氧化反应,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
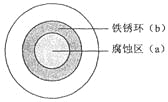
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:

对上述流程中的判断正确的是
A. 试剂X为稀硫酸
B. 结合质子( H+)的能力由强到弱的顺序是:AlO2—> OH— >CO32—
C. 反应II中生成Al(OH)3的反应为:CO2+AlO2- +2H2O =Al(OH)3↓+HCO3-
D. Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用浓硝酸与蛋白质的颜色反应,可鉴别含有苯环的蛋白质
B.用新制氢氧化铜可以鉴别丙三醇、丙醛、丙酸
C.甘氨酸可以以![]() 的形式从水溶液中结晶析出
的形式从水溶液中结晶析出
D.除去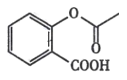 中的杂质
中的杂质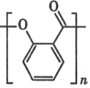 :加足量饱和NaHCO3溶液 ,过滤
:加足量饱和NaHCO3溶液 ,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。

(1)X元素在元素周期表中的位置________。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________(用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________(用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________。关于该电池的下列说法,正确的是_________。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______+______MnO4- + ________H+ = ______CO2 + _______Mn2++______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O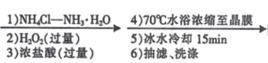 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体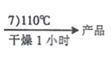
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,A的单质为密度最小的气体,B、W同周期,A、D同主族,A与W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式___________________________。
(2)由A、W元素组成的18电子分子的电子式为__________________________。
(3)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式____________________________。
(4)向含有Fe2+和淀粉KI的溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I- 时,共转移3mol电子,该反应的离子方程式是_______________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放氢气,若将1mol DA和1mol E单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com