
����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3����Fe2O3�����ʣ�Ϊԭ��ұ�����Ĺ����������£�

�����������е��ж���ȷ����
A. �Լ�XΪϡ����
B. ������ӣ� H+����������ǿ������˳���ǣ�AlO2���� OH�� ��CO32��
C. ��ӦII������Al(OH)3�ķ�ӦΪ��CO2��AlO2�� ��2H2O ��Al(OH)3����HCO3��
D. Al2O3�۵�ܸߣ���ҵ�ϻ��ɲ��õ������AlCl3ұ��Al
���𰸡�C
��������
�ɹ�������ͼ��֪���Լ�X������������Һ��Al2O3��������������Һ�õ�NaAlO2��Һ��Fe2O3������������Һ����Ӧ�����Է�Ӧ�ٹ��˺�������Һ��ΪNaAlO2��Һ������ΪFe2O3��YΪCO2����NaAlO2��Һ��ͨ�����CO2�Ļ�ѧ����ʽΪNaAlO2+CO2+2H2O=Al(OH)3��+NaHCO3�����˷���������Al2O3�õ�����Al���Դ˽����⡣
A. ��������������������ֻ�����������Ƶ�ǿ����Һ��������ϡ���ᣬ�����������������Ʒ�Ӧ������������Ӧ�������߶�����ϡ���ᷴӦ����A����
B. �����������Խǿ����Ӧ����ų����ӵ�������Խ�������Ӧ������Ծ�Խ�������ԣ�HCO3�� > Al(OH)3>H2O�����Խ������������OH��>AlO2�� >CO32������B����
C. ������������֪����ӦII������Al(OH)3�ķ�ӦΪ��CO2��AlO2����2H2O ��Al(OH)3����HCO3������C��ȷ��
D. �Ȼ����Ƿ��Ӿ��壬����ʱ���ܵ�������ӣ�������ڵ��Ȼ������ܻ�ý���������D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[���ʽṹ������]
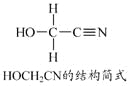
[Zn(CN)4]2�C��ˮ��Һ����HCHO�������·�Ӧ��
4HCHO+[Zn(CN)4]2�C+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
��1��Zn2+��̬��������Ų�ʽΪ____________________��
��2��1 mol HCHO�����к�����������ĿΪ____________mol��
��3��HOCH2CN������̼ԭ�ӹ�����ӻ�������______________��
��4����H2O���ӻ�Ϊ�ȵ������������Ϊ________________��
��5��[Zn(CN)4]2�C��Zn2+��CN�C��Cԭ���γ���λ���������ǿռ乹�ͣ�[Zn(CN)4]2�C�Ľṹ����ʾ��ͼ��ʾΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���ͺ����к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
ij��ѧ��ȤС�齫�������̢�������Ƴ�����ͼ��ʾ������
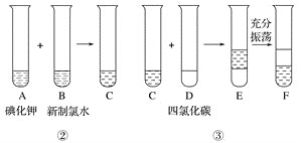
��֪���̢ڷ�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI===2KCl��I2
�ش��������⣺
��1��д����ȡ���̢�������ʵ����������ƣ���____________����____________��
��2�������չ����У�ʹ�õ���ʵ�������оƾ��ơ�____________��____________(����������)��
��3��F���²�Һ�����ɫΪ________ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�Ϊ____________��
��4����F�еõ���̬�����еIJ�����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���磭Fenton��������ˮ�����л���Ⱦ�オ��ĸ�������������Ӧԭ����ͼ��ʾ����������H2O2��Fe2+������Ӧ���ɵ��ǻ����ɻ�����OH�������������л���Ⱦ�����˵���������
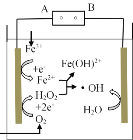
A.��Դ��A��Ϊ����
B.���ԴB�������缫�ĵ缫��ӦʽΪH2O��e- ��H+����OH
C.Fenton��ӦΪ��H2O2��Fe2+��Fe(OH)2+����OH
D.ÿ����2.24LO2����״���������������������Ͽɲ�������OHΪ0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K��Al��Si��Cu��Ni��Ϊ��Ҫ�ĺϽ���ϣ��ڹ�ҵ�������Ƽ��������������Ź㷺����;����ش��������⣺
��1��KԪ�ش���Ԫ��ͬ�ڱ���_____����
��2������״̬�����У����������һ��������������������______�����ţ���
A. [Ne]![]() �� B.[Ne]
�� B.[Ne]![]()
![]() �� C.[Ne]
�� C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
�� �� 3s�� 3s��3p 3s��3p 3s��3p 3p
��3���Ӻ�������Ų��ǶȽ�������Cu2O��CuO���ȶ���ԭ����_____________��
��4��һЩ��������۵����±���ʾ��
������ | NaCl | KCl | SiO2 |
�۵�/��C | 801 | 770 | 1723 |
���ͱ��л�����֮���۵�����ԭ��________________________________��
��5��NiSO4���ڰ�ˮ�γ�[Ni(NH3)6]SO4��
��N��O��S����Ԫ���е縺��������_______��
��д��һ����[Ni(NH3)6]SO4�е������ӻ�Ϊ�ȵ�����ķ��ӵķ���ʽ_________��
��1mol[Ni(NH3)6]SO4�к�����������ĿΪ___________��
��NH3��VSEPRģ��Ϊ____��NH3��SO42-������ԭ�ӵ��ӻ����ͷֱ�Ϊ___��___��
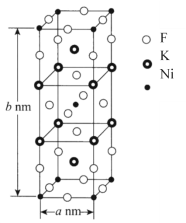
��6��K��Ni��F����Ԫ����ɵ�һ�־���ij����徧���ṹ��ͼ��ʾ����NAΪ�����ӵ�������ֵ���þ�����ܶ���=______g��cm-3(�ô���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʴ�йص�˵����ȷ���ǣ�������
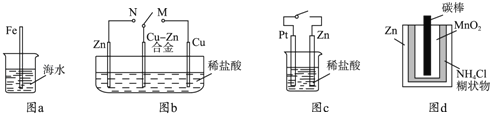
A.ͼa�У����뺣ˮ�е�������Խ�����˸�ʴԽ����
B.ͼb�У�������M������Nʱ��Cu��Zn�Ͻ�ĸ�ʴ���ʼ�С
C.ͼc�У���ͨ����ʱZn��ʴ��������Zn�Ϸų����������Ҳ����
D.ͼd�У�Zn��MnO2�ɵ���Էŵ縯ʴ��Ҫ����MnO2���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���б仯�ķ���ʽ��
A.HSO3-���룺HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
B.NaHCO3��Һ�м����������CO32-+2H+=CO2��+ H2O
C.KI ��Һ�м��� H2SO4 �� H2O2�� 2I-+H2O2 =I2+2OH-
D.��ʯī�缫��� CuCl2��Һ ��Cu2++2C1-+2H2O![]() Cu(OH)2��+H2�� + Cl2 ��
Cu(OH)2��+H2�� + Cl2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ȽϽ��e-���������ǿ����Cl2__________S(�������<��)����һ�����ӷ���ʽ˵��Cl2��S���e-���������ǿ��_______��
(2)KCN �����ӻ������ԭ�Ӿ�����8 �����ȶ��ṹ��д�� KCN�ĵ���ʽ______��
(3)�ڳ�ѹ�£�CBr4�ķе�(190��)��CCl4�ķе�(76.8��)�ߡ���Ҫԭ���� ____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ͨ����������+Ũ����![]() �����Ȼ���+ˮ+������ԭ����ȡ����Cl2���ֽ�һ��������NaClO����100 mL 10.00 mol��L-1��Ũ�����У����ɵ�Cl2�ڱ�״���µ����Ϊ1.12 L���Լ��㣨��Ӧǰ����Һ������仯���Բ��ƣ���
�����Ȼ���+ˮ+������ԭ����ȡ����Cl2���ֽ�һ��������NaClO����100 mL 10.00 mol��L-1��Ũ�����У����ɵ�Cl2�ڱ�״���µ����Ϊ1.12 L���Լ��㣨��Ӧǰ����Һ������仯���Բ��ƣ���
��1����Ӧ�����У���������HCl�����ʵ���Ϊ____mol��
��2����Ӧ����Һ��HCl�����ʵ���Ũ��Ϊ____mol��L-1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com