
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
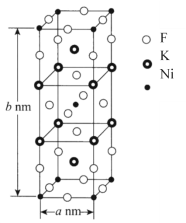
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
【答案】s A 基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”) NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl O CX4、SiX4(X表示卤素原子,任写一种) 28NA 四面体形 sp3 sp3 ![]()
【解析】
(1)K元素的价电子排布式为4s1,最后的电子排在s轨道上,所以处于元素同期表的s区。
答案为s;
(2)在第三周期,轨道的能量3s<3p,电子的能量越低,电离时消耗的能量越高,所以3s轨道上的电子电离时消耗的能量最高。答案为A;
(3)从核外电子排布角度看,基态Cu+的价电子排布式为3d10,为全充满状态,更稳定。
答案为:基态Cu+的价电子排布式为3d10,为全充满状态,更稳定(或“Cu+离子核外电子处于稳定的全充满状态”)
(4)从表中可以看出,KCl、NaCl的熔点相近,而SiO2的熔点高。因为NaCl、KCl为离子晶体,SiO2为原子晶体,所以SiO2的熔点高;K+半径大于Na+半径,晶格能NaCl >KCl,所以NaCl的熔点高。
答案为:NaCl、KCl为离子晶体,SiO2为原子晶体;K+半径大于Na+半径,晶格能NaCl >KCl
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
① N、O、S三种元素中电负性最大的是O。答案为O
② [Ni(NH3)6]SO4中的阴离子为SO42-,它的价电子数为42,与它互为等电子体的分子为CX4、SiX4(X表示卤素原子,任写一种)。答案为CX4、SiX4(X表示卤素原子,任写一种)
③在[Ni(NH3)6]SO4中,[Ni(NH3)6]2+含有24个δ键,SO42-中含有4个δ键。所以1mol[Ni(NH3)6]SO4中含有δ键的数目为28NA。答案为28NA
④NH3的VSEPR模型为四面体。答案为四面体形
NH3的中心原子的杂化类型sp3,答案为sp3。
SO42-的中心原子的杂化类型为sp3,答案为sp3。
(6)从K、Ni、F三种元素组成的一种晶体的长方体晶胞结构图,我们可以得出该物质的化学式为K4Ni2F8,它的相对分子质量为426,则该晶体的密度
ρ= ![]() ×1023g·cm-3。答案为:
×1023g·cm-3。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用离子方程式(不能用离子方程式的用化学方程式)解释下列实验事实
⑴用纸层析法分离Fe3+、Cu2+时,氨熏显色后出现蓝色斑点_______________________________________________________________________ 。
⑵用新制的氢氧化铜检验牙膏中的甘油______________________________________________________________________ 。
⑶用AgNO3溶液、稀硝酸和NaNO2溶液直接检验火柴头中的氯元素_______________________________________________________________________ 。
⑷用水杨酸和乙酸酐在酸性条件下制备阿司匹林________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,分子中碳与氢元素的质量比为6:1,,是同系物中最简单的物质。X为有浓郁香味、不易溶于水的油状液体。它们之间的转化关系如图:
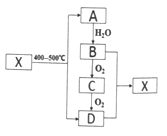
请回答:
(1)有机物D中含有的官能团名称是_________。
(2)A→B的反应类型是_______________。
(3)有机物X在400~500℃下转化为A和D的化学方程式是_____________________。
(4)下列说法正确的是_______________。
A.工业上获得A的的主要方法是催化裂化
B.将绿豆大小的钠投入到B中,钠块浮在液面上,并产生气泡
C.除去C中的D可以先加饱和碳酸钠溶液再蒸馏
D.一定条件下,1molX与足量NaOH溶液反应时,最多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:

对上述流程中的判断正确的是
A. 试剂X为稀硫酸
B. 结合质子( H+)的能力由强到弱的顺序是:AlO2—> OH— >CO32—
C. 反应II中生成Al(OH)3的反应为:CO2+AlO2- +2H2O =Al(OH)3↓+HCO3-
D. Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:
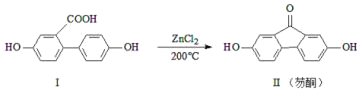
①化合物Ⅱ中含氧官能团为_____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是______________________。
(2)沉淀c的化学式是__________________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com