
【题目】在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
【答案】铜 HNO3 Cu(NO3)2 Cu 1:4 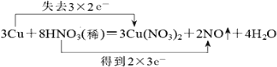 24NA 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
24NA 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,据此分析解答。
(1)该反应中Cu元素失电子被氧化,HNO3中部分N元素被还原,故HNO3是氧化剂;
(2)该反应中铜是还原剂,则氧化产物是Cu(NO3)2,还原剂发生氧化反应,所以铜发生氧化反应;
(3)被还原的硝酸是生成NO的硝酸,则被还原的HNO3与参加反应的HNO3物质的量之比为2:8=1:4;
(4)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,用双线桥标出该反应电子转移的方向和数目为: ;
;
(5)作氧化剂的HNO3中N元素化合价由+5价变为+2价,故有8mol HNO3被还原时,转移电子数为:8mol×3×NA mol-1=24NA;
(6)硝酸为一元强酸,硝酸铜为可溶性盐,书写离子反应方程式时拆分,故该反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
。


科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]3H2O),常作为有机反应的催化剂,溶于水,难溶于乙醇。实验室可用摩尔盐等为原料制备,具体流程如图:
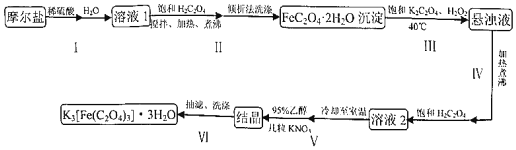
(1)《实验化学》中制备摩尔盐的化学方程式为______
(2)步骤1中少量稀硫酸的作用是______,步骤Ⅱ中过量饱和草酸的作用是______
(3)请设计实验方案证明FeC2O42H2O晶体已经洗涤干净:______
(4)步骤Ⅲ在40℃条件下进行的原因______
(5)步骤Ⅵ抽滤如图安装好装置,请按正确操作顺序补充完整:
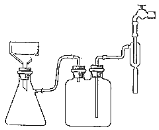
在布氏漏斗中加入滤纸→______→确认抽干
a、转移固液混合物;b、开大水龙头;c、关闭水龙头;d、微开水龙头;e、加入少量蒸馏水润湿滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
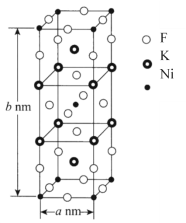
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列变化的方程式是
A.HSO3-电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
B.NaHCO3溶液中加入少量盐酸:CO32-+2H+=CO2↑+ H2O
C.KI 溶液中加入 H2SO4 和 H2O2: 2I-+H2O2 =I2+2OH-
D.用石墨电极电解 CuCl2溶液 :Cu2++2C1-+2H2O![]() Cu(OH)2↓+H2↑ + Cl2 ↑
Cu(OH)2↓+H2↑ + Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
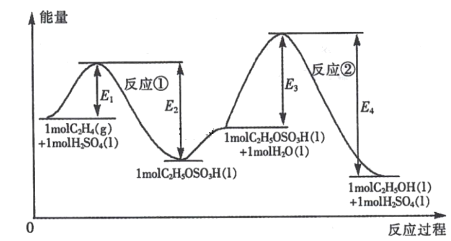
A.H2SO4是该合成过程的催化剂
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( )
A. 在常温常压下,11.2LO2含有的分子数为0.5NA
B. 71gCl2所含原子数为2NA
C. 标准状况下,22.4LH2O含有的分子数为1NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求:
①被氧化前钠块的质量__________________。
②所得溶液中溶质的质量分数_____________(计算结果均保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com