
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
(1)K2SiF6+3H2O=2KF+H2SiO3+4HF(2分) HF+OH—=F—+H2O (2分)
(2)偏高(2分)
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml(2分)
关系式:SiO2~Si~4HF~4NaOH
60g 4mol
m(SiO2) 20.00×10—3L×1.0mol·L-1
求得m(SiO2)=0.30g(2分)
硅元素的质量分数(以二氧化硅计):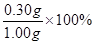 =30%(2分)
=30%(2分)
【解析】
试题分析:(1)过滤除去硅酸沉淀,溶液中HF与氢氧化钠溶液反应;(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,导致滴定管中氢氧化钠溶液浓度降低,滴定相同量HF消耗的体积增大,故测得的硅元素含量将偏高;(3)剔除偏差较大的读数(16.80),平均体积为20.00mL,根据关系式计算可得。
考点:考查滴定计算及误差分析等有关问题。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
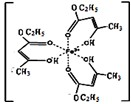 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.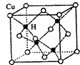 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
[化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.查看答案和解析>>
科目:高中化学 来源:2007年江苏省前黄高级中学高三化学二模模拟试题 题型:021
|
绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展.而常温离子液体(ionicliquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实.1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是 | |
A. |
离子液体可以作为电池的电解质 |
B. |
硝酸乙基铵水溶液呈碱性 |
C. |
硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+ |
D. |
相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式可表示为:C2H5NH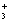 +H2O====C2H5NH2+H3O+
+H2O====C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com