
【题目】KCl与KNO3在不同温度的溶解度数据如下表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两种物质的溶解度相等的温度在20~30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余
【答案】B
【解析】解:A.没有指明温度无法比较溶解度的大小,故A错误; B.分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,故B正确;
C.20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液,溶液为过饱和溶液,质量分数为 ![]() ×100%=24.8%,故C错误;
×100%=24.8%,故C错误;
D.50℃时KCl溶解度是41g,相当于100g水最多溶解氯化钾41g,10g水中最多溶解氯化钾4.1g,有固体剩余;50℃时硝酸钾溶解度是88g,相当于100g水最多溶解硝酸钾88g,10g水中最多溶解硝酸钾8.8g,无固体剩余,故D错误;
故选:B.
【考点精析】利用溶解度、饱和溶液的概念对题目进行判断即可得到答案,需要熟知在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度.


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) 下列说法正确的是
CH3OCH3(g)+H2O(g) 下列说法正确的是
编号 | 温度 | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387℃ | 0.20 | 0.080 | 0.080 |
Ⅱ | 387℃ | 0.40 | ||
Ⅲ | 207℃ | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
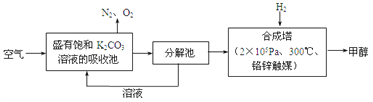
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
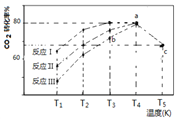
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
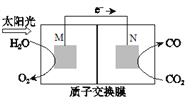
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能比较次氯酸与醋酸的酸性强弱的是
A. 0.10 mol·L-1的次氯酸和醋酸的pH分别为4.8和3.1
B. 次氯酸的导电能力低于相同浓度的醋酸
C. 醋酸的稳定性强于次氯酸
D. 次氯酸不能与碳酸氢钠溶液反应,而醋酸可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内的是杂质)所选用的试剂合理的是( )
A.Al (Fe):浓硝酸
B.MgO(Al2O3):盐酸
C.FeCl3(FeCl2):氯水
D.FeCl2(CuCl2):氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和H2S会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
(1)用氨水除去SO2:
已知 25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,NH3·H2O的 Kb=1.8×l0-5。
①试写出H2SO3在水溶液中的电离方程式__________________,从电离平衡的角度解释Ka1、Ka2差别很大的原因_________________。
②若氨水的浓度为0.02 mol·L-1,溶液中的c(OH-)=____________mol·L-1、将SO2通入该氨水中,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,溶液的pH=_____________。
(2)生物脱H2S:
原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
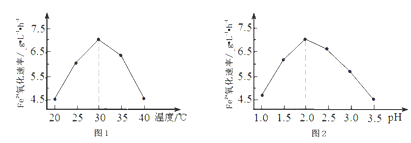
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______________ 。
②由图1和图2判断使用硫杆菌的最佳条件为________________ ,若反应温度过高,反应速率下降,其原因是__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),下图中的曲线是该反应在不同温度下的平衡曲线,则下列描述正确的是
2C(g),下图中的曲线是该反应在不同温度下的平衡曲线,则下列描述正确的是

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1时若由a点达到平衡,可以采取增大压强的方法
D. c点v正逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com