
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 0.5mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 0.5mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:| 1000ρω |
| M |
| n |
| V |
| 1000×1.18×36.5% |
| 36.5 |


科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8 g的NH4+离子中含有的电子数为NA |
| C、常温常压下,32g O2含有的氧原子数为3NA |
| D、4.6g金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
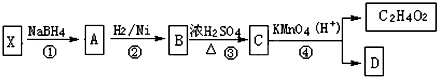
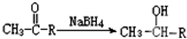
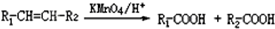
| 编号 | 信息 |
| (1) | X分子中没有支链 |
| (2) | 1mol X需要1mol NaOH 完全中和,1mol X可以和1mol Br2完全加成 |
| (3) | X的相对分子质量在180~190之间 |
| (4) | X完全燃烧生成的二氧化碳和水的物质的量之比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下在c(H+)=1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| B、使甲基橙试液变红的溶液中可能大量存在Na+、ClO?、SO42?、I? |
| C、使PH试纸变蓝的溶液中可大量存在Na+、K+、AlO2-、CO32- |
| D、常温下,在水电离产生的c(H+)×c(OH-)=1×10-24的溶液中可大量存在Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是否能透过滤纸 |
| B、分散质粒子直径的大小 |
| C、是否会产生丁达尔效应 |
| D、是否为均一、稳定、透明的外观 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Fe与S能直接化合得FeS,推测Cu与S化合直接化合生成CuS |
| B、已知H2O比H2S的沸点高,推测H2S比H2Se的沸点高 |
| C、已知A12S3不能在水溶液中存在,推测Mg3N2不能在水溶液中存在 |
| D、已知工业上用电解熔化的NaCl制取Na,推测用熔化的A1C13制取Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com