
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
A. ��ȥNaCl�����е�����KNO3��Ӧ�������ܽ�������ᾧ�����ȹ��ˣ�ϴ�Ӹ���
B. ��FeCl3�����ܽ���ʢ����������ˮ���ձ��У��پ�ת�ơ�ϴ�ӡ����ݺ�ҡ�ȾͿ���������ƿ�����Ƴ�һ��Ũ�ȵ�FeCl3��Һ
C. ������Һ�е�SO![]() ʱ����Ҫ����Һ�м��������ữ���Ȼ�����Һ
ʱ����Ҫ����Һ�м��������ữ���Ȼ�����Һ
D. ���ˮ����μ��뱥���Ȼ�����Һ���������Ƚ���ɵõ�������������
���𰸡�A
��������
A. NaCl���ܽ�����¶�Ӱ�첻������ص��ܽ�����¶�Ӱ��������������������������ص�NaCl�ܽ�������ᾧ�����ȹ��ˣ�ϴ�Ӹ���ɳ�ȥ����أ�A����ȷ��
B. FeCl3����ˮ�������������������ᣬ��������ƹ����У�Ӧ�������ᣬĿ����������ˮ�⣬���ձ����ܽ⡢��ȴ���پ�ת�ơ�ϴ�ӡ����ݺ�ҡ�ȾͿ���������ƿ�����Ƴ�һ��Ũ�ȵ�FeCl3��Һ��B�����
C. Ӧ�ȼ������ų��������ӣ�Ȼ���ټ��Ȼ�����Һ����SO42-��C�����
D. ���Ƚ����ʹ���巢���۳���D�����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С������ͼװ�ý���ʵ�飬K��N���Իش�
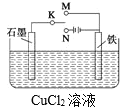
(1)ʯī��Ϊ______��(������������������������ ��������)�������ϵĵ缫��ӦΪ��_______������ܷ�ӦΪ��________��Cu2+��____(����ʯī����������)�缫�ƶ���
(2)����Ӧ��������0.1mol�ĵ��ӷ���ת�ƣ������缫�ϲ������ʵ�����Ϊ____g��ʯī���ϲ��������ʵ����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л���A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ1��ʾ��
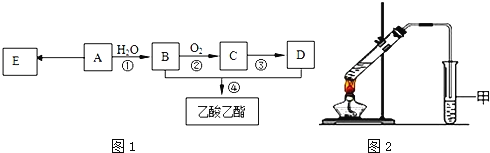
��1��A�����й����ŵ�������______��D�й����ŵ�������______����Ӧ�ٵķ�Ӧ������______��Ӧ��
��2����Ӧ�ڵĻ�ѧ����ʽ��______����Ӧ�ܵĻ�ѧ����ʽ��______��
��3��E�dz����ĸ߷��Ӳ��ϣ��ϳ�E�Ļ�ѧ����ʽ��______��
��4��ijͬѧ����ͼ2��ʾ��ʵ��װ����ȡ��������������ʵ��������Թܼ����ϲ�Ϊ���ġ�������ˮ����״Һ�壮
��ʵ�鿪ʼʱ���Թܼ��еĵ��ܲ�����Һ���µ�Ŀ����______��
������ʵ���б���̼������Һ�������ǣ�����ĸ��______��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�������������ɣ���������
D�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ������Ҫ0.5mol��L-1������Һ450mL��������Һ����������ش��������⣺
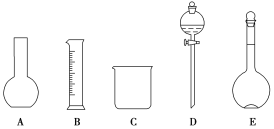
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����__(�����)������������Һ�����õ��IJ���������___(����������)��
��2��������������Ϊ98%���ܶ�Ϊ1.84g��cm-3��Ũ����������450mL��0.5mol��L-1��ϡ���ᡣ��������Ũ��������Ϊ__mL(����1λС��)�����Т�10mL ��25mL ��50mL ��100mL���ֹ�����Ͳ����ѡ�õ���Ͳ��__(�����)��
��3������ʱ��һ��ɷ�Ϊ���¼������裺
����ȡ �ڼ��� ��ϡ�� ��ҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ
����ȷ�IJ���˳��Ϊ������������������__��__��__��_(�����)��__
��4�������ƹ����У����в����д������__(����ţ���ͬ)������������ȷ�����������ƫ�ߵ���__��
��ϴ����ȡŨ��������Ͳ������ϴ��Һת�Ƶ�����ƿ��
��δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ��
�۽�Ũ����ֱ�ӵ����ձ��������ձ���ע������ˮ��ϡ��Ũ����
�ܶ���ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
��ת��ǰ������ƿ�к�����������ˮ
����ҡ�Ⱥ���Һ����ڱ��ߣ����ý�ͷ�ιܼ�����ˮ���̶���
�߶���ʱ�����ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ȥ��ͼ��ʾװ���еIJ���Ƭ��ʹ���������ַ�Ӧ(������������Ϊװ������������)�����¶Ȼָ���ԭ���¶ȡ�����˵����ȷ����

A. ��Ӧ��ƿ��ѹǿ�Ƿ�Ӧǰ��![]() B. װ������Ԫ�ص�������Ϊ0.42 g
B. װ������Ԫ�ص�������Ϊ0.42 g
C. ������ķ�����ĿΪ0.1NAD. ��Ӧ��������������ƿ�����ֿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɫ���壬����ζ���ᣬ���ӽṹ��ͼ��ʾ���㷺����ʳƷҵ����ױҵ�ȡ����������ˮ�б�����ˮ�����ܽ⡣�����й��������˵������ȷ����
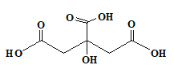
A. ������ˮ�������ʽΪC6H8O7
B. 1mol���������������Ʒ�Ӧ�������2molH2
C. ���ø����ܽ����ؽᾧ����
D. ����ʳƷ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.50 mL 1.0mol��L��1�����50 mL 1.1 mol��L��1����������Һ��ͼ��ʾװ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ��Իش��������⣺
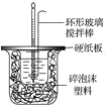
��1��___���������������������������β����������Ϊ���ν�������ͭ������
��2�����ձ����粻��Ӳֽ�壬������к�����ֵ��Ӱ����__������ƫ������ƫ����������Ӱ��������
��3���������60 mL 1.0 mol��L��1�����50 mL 1.1 mol��L��1����������Һ���з�Ӧ����������ʵ����ȣ���������__���������������������������������������к�����ֵ__����������������������������������
��4��__������������������������Ba��OH��2������������������������Һ��
��5��Q=cm��t������Q��ʾ���кͷ�Ӧ�ų���������m��ʾ��Ӧ����Һ��������c��ʾ��Ӧ������Һ�ı����ݣ���t��ʾ��Ӧǰ����Һ���¶ȵIJ�ֵ����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼����ԭʼ���ݣ�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2��t1��/�� |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00 g��cm��3���кͺ���Һ�ı�����c=4.184��10��3kJ��g��1������1��÷�Ӧ���к���Ϊ��H=__������С�����һλ����
��6������ʵ����ֵ�����57.3 kJ��mol��1��ƫ�����ƫ���ԭ�������__������ĸ����
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨHCl��Һ���¶�
II. �������������������������ܹ�������Ӧ��
���� 0.1 mol/L KMnO4������Һ��0.5 mol/L H2C2O4��Һ���о���ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣ʵ����̵����ݼ�¼ (������)�����ϱ�����Ϣ���ش��й����⣺
ʵ�� ��� | ��Ӧ�¶�/�� | �μӷ�Ӧ������ | |||||
KMnO4��H2SO4�� | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol��L��1 | V/mL | c/mol��L��1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 10 | 0.5 | 0 | 0 | |
��1��д����Ӧ�Ļ�ѧ����ʽ____________________________________��
��2������о������Ի�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ��________��________(��A��E��ʾ����ͬ)
��3������о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ��________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ�����þ��Ԫ���������������й㷺����;�����������գ�
���Ƶ���Ҫ������
��1����ˮ����ֳ�ϣ���������Ƴ����ڳ�ȥ����ˮ�е������������ϣ�ȥ��1g��������Ҫ0.56g��������ƣ���Ӧ�����ӷ���ʽΪ______��
��2����ȥAl2O3�л��е�Fe2O3���ɽ���������ڹ��������ᣬ�ټ���Na2CO3����pHʹFe3+������ȫ��Al3+���������û�ѧ���P��Ӧ�����ӷ���ʽ���ͼ���Na2CO3��Ŀ��______��
��������Ҫ������
��3����������FePO42H2O��������ˮ���װ�ɫ���壩����������ҩ�ʳƷ���Ӽ�������ӵ�ص��������ϡ�ʵ���ҿ�ͨ������ʵ���Ʊ���������
�ٳ�ȡһ�����ѳ�ȥ���۵ķ���м�������Թ�����ϡ���ᣬ���ȡ����裬��Ӧһ��ʱ�����ˣ���Ӧ���ȵ�Ŀ����______��
������Һ�м���һ����H2O2����Fe2+��Ϊȷ������H2O2������������K2Cr2O7����Һ�ζ���Һ�е�Fe2+������ζ�����ע��K2Cr2O7����Һǰ���ζ�����Ҫ��©��______��______��
�۽�һ������Na2HPO4��Һ����Һ�Լ��ԣ����뵽����Fe3+����Һ�У����衢���ˡ�ϴ�ӡ�����õ�FePO42H2O������Ӧ�õ���FePO4H2O������ػ�ɫ�����������л��е����ʿ���Ϊ______��
��þ����Ҫ������
��4������þ��̼����������һ�������·�Ӧ���Ʊ��Ȼ�þ����β����������������������Һ��ȫ���գ������ɵ���Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ��������м�ǿ�������ԣ�����ʹ�����ĺ������ʷ���������Ӧ���Ӷ�ɱ�����dz��õ���������Ư������֪��
��.���³�ѹ�£�Cl2O Ϊ�ػ�ɫ���壬�е�Ϊ 3.8�棬42 �����ϻ�ֽ����� Cl2 �� O2��Cl2O ������ˮ����ˮ������Ӧ���� HClO��
��.�������Ϳ���(�����뷴Ӧ)�������1��3 ���ͨ�볱ʪ��̼����������Cl2O ���壬��ˮ����Cl2O(���� Cl2)�Ƶô�������Һ��ijʵ������������װ���Ʊ�Ũ�Ȳ�С�� 0.8mol/L �Ĵ�������Һ��
A.  B.
B.  C.
C.  D.
D.  E.
E. 
�ش��������⣺
(1)װ��D ������Ϊ_______________��
(2)��ƽװ�� B �еķ�Ӧ___________��Cl2+Na2CO3+H2O = Cl2O+NaCl+NaHCO3��д��Cl2O �ĽṹʽΪ_____��
(3)װ��C �м�����Լ�X ΪCCl4����������__________��
(4)��װ�õ�����˳��Ϊ A��____________��____________��______________��E��
(5)�˷������������ֱ������ˮ�Ʊ���������Һ���ŵ���__________��(��� 1 ������)
(6)��װ�� B �����ɵ� Cl2O ������ 20%������E ǰ��װ���У����������װ��E ��ˮ�У�װ��E ���� 500mL ��������ҺŨ��Ϊ 0.8mol/L����������Ҫ��ˮ 8%��̼���Ƶ�����Ϊ_____g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com