
【题目】实验室利用氯酸钾和二氧化锰制取氧气,反应后从剩余固体中回收纯净的二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤D.溶解、洗涤、过滤、加热
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为_________________________。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
(4)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式___________________________________________________。步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外还可能使产品中混有杂质____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下列能量变化示意图,请写出![]() 和CO反应的热化学方程式______。
和CO反应的热化学方程式______。

(2)在固定体积的密闭容器中,进行如下化学反应: ![]()
![]() H<0,其平衡常数K与温度T的关系如下表:
H<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K |
|
|
|
①试判断![]() ______
______![]() (填写>、=,<)
(填写>、=,<)
②下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2
b. ![]()
c. 容器内压强保持不变
d. 混合气体的密度保持不变
(3)对反应![]()
![]() H>0,在温度分别为
H>0,在温度分别为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如下图所示。
的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率:A_________C(填>、=、<)
②A、C两点![]() 的转化率:A_________C(填>、=、<)
的转化率:A_________C(填>、=、<)
③由状态B到状态A,可以采用的方法是__________。
(4)一定温度下
①若在1L的密闭容器中,充入1 mol![]() 和3 mol
和3 mol![]() 发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则
发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则![]() 的转化率a(
的转化率a(![]() )=______,以
)=______,以![]() 表示该过程的反应速率v(
表示该过程的反应速率v(![]() )=_________.
)=_________.
②若在1L的密闭容器中,充入2mol![]() 和6mol
和6mol![]() 发生反应,并维持压强恒定,达到平衡时,
发生反应,并维持压强恒定,达到平衡时, ![]() 平衡浓度比①中
平衡浓度比①中![]() 平衡浓度的2倍________。(填>、=、<)
平衡浓度的2倍________。(填>、=、<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. C![]() CO2
CO2![]() CO
CO![]() CO2
CO2
B. Na2SO3![]() SO2
SO2![]() H2SO3
H2SO3
C. CaCO3![]() CaCl2
CaCl2![]() Ca(ClO)2
Ca(ClO)2
D. N2![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
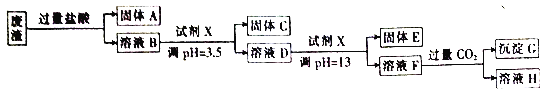
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气__________
②浓硫酸使木条变黑__________
③热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(i)配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
(ii)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL(保留一位小数),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4
B.铝、二氧化硫
C.液态的醋酸、酒精
D.熔融的KNO3、硫酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com