
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

① A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________(填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________(用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO![]() +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________。
【答案】 SO2 使分解产生的气体在B、C中被吸收充分 BD SO3 溶液变浑浊 小于 SO2 + H2O2+Ba2+===BaSO4↓+2H+ 滴加最后一滴KMnO4溶液时,溶液呈紫红色且半分钟不褪色 62.72%
【解析】(1)氮元素和铁元素化合价升高,根据在氧化还原反应中化合价有升必有降,化合价降低的应该是硫,所以气体产物中还可能有SO2;故答案为:SO2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;故答案为:使分解产生的气体在B、C中被吸收充分;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子,故选BD,故答案为:BD;
③装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,故答案为:SO3;溶液变浑浊;
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a,故答案为:小于;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H,故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+;
(3)①取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000molL-1 KMnO4溶液滴定至终点,滴加最后一滴KMnO4溶液时,溶液呈微红色且半分钟不褪色,故答案为:滴加最后一滴KMnO4溶液时,溶液呈微红色且半分钟不褪色;
② MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O
1 5
0.01600L×0.1000molL-1n
n=0.008mol,100ml溶液中含亚铁离子物质的量=0.008mol×![]() =0.032mol,产品中(NH4)2Fe(SO4)26H2O的质量分数=
=0.032mol,产品中(NH4)2Fe(SO4)26H2O的质量分数=![]() ×100%=62.72%,故答案为:62.72%。
×100%=62.72%,故答案为:62.72%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液。
I.方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取配置好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是 。
(2)若选用(1)的沉淀剂沉淀后,过滤,洗涤沉淀,判断沉淀是否洗净的方法是 。
II.方案二:量气法。如图所示,量取配制好的溶液与足量稀硫酸溶液反应,测定生成气体的体积,由此计算混合物中ω(Na2CO3)。
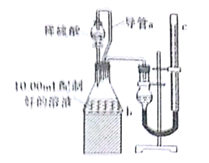
(1)装置中导管a的作用是 。
(2)正确读取气体体积的操作 。
(3)某同学根据方案二的思路提出方案三:把生成的气体通入足量的生石灰,测定增重的质量,由此计算混合物中ω(Na2CO3),若按此方案,则测得的ω(Na2CO3) (填“偏大”“偏小”或“无影响”)。为减小误差,请完善他的方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁、铜及其化合物的说法正确的是
A. 铁和铜在自然界中主要以游离态的形式存在
B. 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
C. 常温下铁与浓硫酸不反应
D. 用激光照射硫酸铜溶液可观察到丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又称“抗坏血酸”,在人体内有重要功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这一过程中维生素C表现了
A. 氧化性 B. 还原性 C. 酸性 D. 催化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硬脂酸甘油酯和乙酸乙酯都属于酯类物质,都能发生皂化反应
B. 制造纸张的原料棉花、制造毛皮大衣的原料皮革,它们的主要成分都是纤维素
C. 在淀粉水解液中加过量NaOH,滴加碘水,如溶液未显蓝色,则证明淀粉水解完全
D. 体积分数75%的乙醇溶液可用于医疗消毒,原理是乙醇使细菌的蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
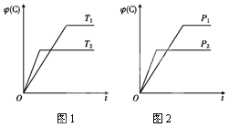
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A. 铈(Ce)元素在自然界中主要以化合态形式存在
B. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+ = Ce3++Fe3+
D. 四种稳定的核素![]() 、
、![]() 、
、![]() 、
、![]() ,它们互称为同位素
,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li![]() Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )

A.闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
B.闭合K1,断开K2时,当0.1 mol Li+从A极区迁移
到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下)
C.取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5 O12 -3e-= Li4Ti5 O12+3 Li+
D.若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com