
| A. | 气体分子数目的多少 | B. | 气体分子微粒大小 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子量的大小 |
分析 在一定温度和压强下,气体分子间距离一定,影响气体体积的因素有分子间距离和分子数目,在相同条件下,气体的分子间距离相等,以此分析.
解答 解:A.在一定温度和压强下,气体分子间距离一定,气体分子微粒大小与分子间距离相比较可忽略不计,所以影响气体大小的因素主要取决于气体分子数目的多少,故A正确;
B.气体分子微粒大小与分子间距离相比较可忽略不计,不是影响气体体积大小的因素,故B错误;
C.在一定温度和压强下,气体分子间距离一定,不是影响气体体积大小的因素,故C错误;
D.气体分子的相对分子质量与气体的体积无关,故D错误.
故选A.
点评 本题考查影响气体体积的因素,题目难度不大,注意相关基础知识的积累.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠固体,不能得到黑色沉淀 | |
| C. | 在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 在烧杯中放入6.24 g 硫酸银固体,加200 g 水,经充分溶解后,所得饱和溶液的体积为200 mL,溶液中Ag+ 的物质的量浓度为0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
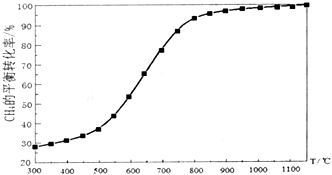 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | α1+α3<1 | B. | a+b>92.4 | C. | 2p2<p3 | D. | 2c1>c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在任何溶液中,若有CaSO4沉淀析出,则c(Ca2+)与c(SO42-)一定相等 | |
| B. | d点溶液通过蒸发可以变到c点 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com