
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠固体,不能得到黑色沉淀 | |
| C. | 在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 在烧杯中放入6.24 g 硫酸银固体,加200 g 水,经充分溶解后,所得饱和溶液的体积为200 mL,溶液中Ag+ 的物质的量浓度为0.2 mol•L-1 |
分析 A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.硫酸银难溶于水,加入200g水为饱和溶液,可结合Ksp计算.
解答 解:A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,混合后,c(Cl-)=1.5×10-5mol/L×$\frac{5}{5+0.05}$,c(Ag+)=1.0×10-3mol/L×$\frac{0.05}{5+0.05}$,则c(Cl-)×c(Ag+)=1.5×10-5mol/L×$\frac{5}{5+0.05}$×1.0×10-3mol/L×$\frac{0.05}{5+0.05}$<1.8×10-10,则没有沉淀生成,故C正确;
D.硫酸银难溶于水,加入200g水为饱和溶液,c(Ag+)=2(SO42-),c(Ag+)=$\root{3}{2×1.4×1{0}^{-5}}$mol/L=3×10-2mol/L,故D错误.
故选C.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 常温常压下,5.6g乙烯(C2H4)与丁烯(C4H8)的混合物中含有的氢原子的数目为0.8NA | |
| C. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 1mol Fe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
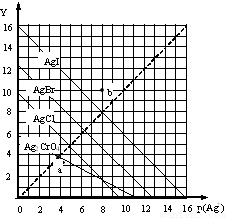 卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )
卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点时c(Ag+)=c(I-),AgI处于平衡状态 | |
| C. | b点可表示AgBr的不饱和溶液 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用所学知识回答下列问题
利用所学知识回答下列问题| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com