
【题目】汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化.请回答:
(1)CO与NO反应的化学方程式为 .
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是 .
(3)控制城市空气污染源的方法可以有(填字母). a.开发新能源b.使用电动车c.植树造林d.戴呼吸面具.
【答案】
(1)2CO+2NO ![]() 2CO2+N2
2CO2+N2
(2)SO2转化为SO3,产生了硫酸酸雾
(3)abc
【解析】解:(1)可知催化转化器的作用是让CO与NO反应,生成无毒气体,治理的目的是除去污染气体生成无毒的气体,依据元素守恒可得产物为CO2和N2,故化学方程式为:2CO+2NO ![]() 2CO2+N2,
2CO2+N2,
所以答案是:2CO+2NO ![]() 2CO2+N2;(2)由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度,
2CO2+N2;(2)由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度,
所以答案是:SO2转化为SO3,产生了硫酸酸雾; (3)a.开发新能源,如太阳能、风能、潮汐能等对环境是无污染的,减少化石燃料得使用,故a正确;
b.使用电动车,减少了化石燃料的使用,对环境是无污染的,故b正确;
c.植树造林可以净化空气,保护环境,但不能从源头上控制污染,故c错误;
d.戴呼吸面具,呼吸面具是在空气中有极度危险的病菌或污染物是佩戴的,平时的生活中是不宜戴的,故d错误
所以答案是:ab.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: 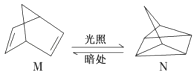
△H=+88.6kJ/mol,则M、N相比,较稳定的是 .
(2)已知CH3OH(l)的燃烧热△H=﹣238.6kJ/mol,CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
O2(g)═CO2(g)+2H2(g)△H=﹣a kJ/mol,则a238.6(填“>”“<”或“=”).
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2 , 当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: .
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为 .
(5)汽车排出的尾气中含有CO和NO等气体.为了解决污染问题,在汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物CO和NO转化为无毒的大气循环物质.已知: N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
请写出污染物CO和NO转化为无毒的大气循环物质的热化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为__________,钒有+2、+3、+4、+5 等多种化合价,其中最稳定的化合价是______________,VO43-的几何构型为___________。
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①该药物中S 原子的杂化方式是____________,所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是___________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域П键”,下列物质中存在“离域П键”的是___________。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为_____________。图4为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )。
A.Fe3+、K+、Cl-、NO3-B.Ag+、Na+、NO3-、Cl-
C.Zn2+、Al3+、SO42-、Cl-D.Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是 .
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 , 则c1与c2的比值等于 .
(3)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2molL﹣1H2SO4溶液.电极c上发生的电极反应式为 , 当电池中有1mole﹣发生转移时左右两侧溶液的质量之差为g (假设反应物a、b耗尽,忽略气体的溶解).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100molL﹣1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步: A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) .
(2)上述B步骤操作的目的是 .
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高“、“偏低”或“不变”).
(4)判断到达滴定终点的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(结构式如图所示)属于欧盟批准使用的食品添加剂。亚铁氰化钾不稳定,受热易分解:3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C;K4[Fe(CN)6]+K2CO3
12KCN+Fe3C+2(CN)2↑+N2↑+C;K4[Fe(CN)6]+K2CO3![]() 5KCN+KOCN+Fe+CO2↑。
5KCN+KOCN+Fe+CO2↑。

(1)基态Fe原子的未成对电子数为___________;K4[Fe(CN)6]中Fe2+与CN-的中心原子形成的化学键类型为_________________,提供孤电子对的成键原子是________________。
(2)KOCN中阴离子OCN-的几何构型为__________,中心原子的杂化轨道类型为___________。O、C、N的第一电离能从大到小的顺序为_________________,电负性从大到小的顺序为___________________。
(3)(CN)2的结构式为_______________________。
(4)KCN的晶体结构如图所示,已知晶胞参数a=0.648nm。则K+的配位数为__________,紧邻的两个K+的距离为_____cm,该晶体的密度为______________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下剥有关电解质溶液的说法正确的是( )
A. 向K2S溶液中加水稀释,![]() 会减小
会减小
B. 向醋酸溶液中加NaOH至恰好完全反应,水的电离程度先增大后减小
C. 向含有MgCO3同体的溶液中加入少量盐酸,![]() 会增大
会增大
D. 向CuS和FeS的饱和溶液中加入少量Na2S, ![]() 保持不变
保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验时必须要有安全意识,下列做法错误的是
A.加热试管或烧杯时,应首先擦干外壁上的水
B.不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精及其它易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com