
【题目】按要求回答下列问题:
(1)①1H、2H、3H ②O2和O3 ③12CO2和14CO2 ④金刚石和石墨
同位素的是;同种物质的是;同素异形体的是(填序号).
(2)写出NaHSO4溶液与NaOH溶液反应的离子方程式 .
(3)淡黄色的固体甲可作供氧剂,写出固体甲的电子式 , 固体甲与水的离子方程式 , 0.5mol的固体甲与CO2反应转移的电子数目 .
(4)实验室制备氯气的方法:(写化学方程式),氯气与湿润的Na2CO3反应可制备Cl2O,其化学方程式为 .
【答案】
(1)①;③;②④
(2)H++OH﹣=H2O
(3)![]() ;2Na2O2+2H2O=4Na++4OH﹣+O2↑;0.5NA
;2Na2O2+2H2O=4Na++4OH﹣+O2↑;0.5NA
(4)MnO2+4HCl ![]() MnCl2+Cl2+2H2O;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
MnCl2+Cl2+2H2O;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
【解析】解:(1)具有相同质子数、不同中子数的原子互为同位素,以上组合中只有①互为同位素,由同种元素形成的不同单质互为同素异形体,以上组合中只有②④互为同位素,②④具有相同分子式、相同结构的化合物,是同种物质,所以答案是:①;③;②④;
(2.)NaHSO4溶液与NaOH溶液反应实质是氢离子和氢氧根离子之间的反应,离子方程式为:H++OH﹣=H2O,所以答案是:H++OH﹣=H2O;
(3.)淡黄色的固体过氧化钠可作供氧剂,过氧化钠是钠离子和过氧根离子之间构成的离子化合物,电子式为 ![]() ,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH﹣+O2↑;0.5mol的固体过氧化钠与CO2反应产生碳酸钠和氧气,2mol的固体过氧化钠与CO2反应产生碳酸钠和氧气,转移的电子数目是2mol,0.5mol的固体过氧化钠与CO2反应转移的电子数目是0.5NA , 所以答案是:
,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH﹣+O2↑;0.5mol的固体过氧化钠与CO2反应产生碳酸钠和氧气,2mol的固体过氧化钠与CO2反应产生碳酸钠和氧气,转移的电子数目是2mol,0.5mol的固体过氧化钠与CO2反应转移的电子数目是0.5NA , 所以答案是: ![]() ;0.5NA;
;0.5NA;
(4.)二氧化锰可以和浓盐酸之间反应生成氯气,即MnO2+4HCl ![]() MnCl2+Cl2+2H2O,Cl2O可用氯气与潮湿的Na2CO3反应制得,同时生成两种钠盐,盐为碳酸氢钠和NaClCl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,所以答案是:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
MnCl2+Cl2+2H2O,Cl2O可用氯气与潮湿的Na2CO3反应制得,同时生成两种钠盐,盐为碳酸氢钠和NaClCl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,所以答案是:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应).


科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
计算平衡时A的转化率__________和平衡常数___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 所有主族中都有非金属元素
B. 同周期元素中,ⅦA族元素的原子半径最大
C. ⅥA族元素的原子,其半径越大,越容易得到电子
D. 元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为
A. SiO2 B. Fe2O3、SiO2
C. SiO2、Al2O3 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是
A. 酸性溶液中:Na+、Cl—、OH—、CO32—
B. 碱性溶液中:Fe3+、NH4+、HCO3—、Cl—
C. 无色溶液中:Na+、Cu2+、MnO4—、I—
D. 透明溶液中:Na+、Fe3+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B2C.开始时C的浓度为a molL﹣1 , 2min后C的浓度变为2a molL﹣1 , A和B的物质的量浓度均变为原来的 ![]() ,则下列说法中不正确的是( )
,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(Lmin)
B.反应开始时,c(B)=3a molL﹣1
C.反应2min后,c(A)=0.5a molL﹣1
D.反应2min后,c(B)=1.5a molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用反应Zn+2FeCl3=ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是
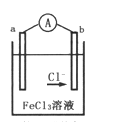
A. Zn为负极,发生还原反应
B. a电极反应式为Zn-2e—=Zn2+
C. 电子流动方向是a电极![]() FeCl3溶液
FeCl3溶液![]() b电极
b电极
D. 电池的正极材料可以选用石墨、铂电极,也可以用铜电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com