
【题目】下列叙述中,正确的是
A. 所有主族中都有非金属元素
B. 同周期元素中,ⅦA族元素的原子半径最大
C. ⅥA族元素的原子,其半径越大,越容易得到电子
D. 元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为 , 生成1mol O2时转移电子的数目是 .
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称: .
(3)分离出的MnO2可用于实验室制取Cl2 , 化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,其离子方程式为 .
MnCl2+Cl2↑+2H2O,其离子方程式为 .
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为
(5)以上两个反应都用到MnO2 , 其作用分别是、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律 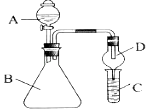
(1)仪器A的名称为 , 干燥管D的作用是 .
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加(填名称),C中加淀粉﹣碘化钾溶液,观察到C中溶液的现象,即可证明.从环境保护的观点,此装置的不足之处是 .
(3)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3 , C中加(填试剂)即可证明.乙同学认为此方案有不足之处,应在B、D两装置间加装有(填试剂)的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl﹣的物质的量浓度为1.3mol/L.要使Mg2+全部转化为沉淀分离出来,至少需要加入 4mol/L NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的两份金属铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为
A. 1∶1 B. 1∶3 C. 2∶3 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中加入 KI 溶液,振荡,再加入四氯化碳后振荡,观察到的现象是
A.液体呈紫色B.液体分两层,上层无色,下层紫色
C.液体分两层,上下均紫色D.液体分两层,上层紫色,下层无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)①1H、2H、3H ②O2和O3 ③12CO2和14CO2 ④金刚石和石墨
同位素的是;同种物质的是;同素异形体的是(填序号).
(2)写出NaHSO4溶液与NaOH溶液反应的离子方程式 .
(3)淡黄色的固体甲可作供氧剂,写出固体甲的电子式 , 固体甲与水的离子方程式 , 0.5mol的固体甲与CO2反应转移的电子数目 .
(4)实验室制备氯气的方法:(写化学方程式),氯气与湿润的Na2CO3反应可制备Cl2O,其化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+2Y2(g) ![]() Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2 mol/L、 0.3 mol/L、0.3 mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2 mol/L、 0.3 mol/L、0.3 mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A.c(Z)=0.45 mol/L B.c(X2)=0.3 mol/L c(Z)=0.1 mol/L
C.c(X2)=0.5 mol/L D.c(Y2)=0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5 mol能与1 molHCl完全加成,加成后的产物分子上的氢原子又可被2 molCl2完全取代。则此气态烃可能是( )
A. HC≡CH B. CH2=CH2
C. HC≡C-CH3 D. CH2=C(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com