
【题目】世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. Fe2O3粉尘 C. Fe粉尘 D. 碳粉
科目:高中化学 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是
A.甲烷和乙醇 B.乙烷和乙醇
C.苯和苯甲酸 D.乙炔和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. 含有M元素的化合物均可与强酸、强碱反应
B. 原子半径Z<X<M
C. Z2与Z3互为同素异形体
D. Y的最高价氧化物对应水化物的酸性比X的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使蛋白质从溶液中析出,而又不改变它的性质,应加入( )
A. 饱和(NH4)2SO4溶液 B. 稀NaOH溶液 C. 饱和CuSO4溶液 D. 乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
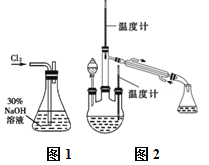
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 键能愈大,表示化学键越牢固,越难以断裂
B. 成键的两原子核越近,键长越短,化学键越牢固,形成的物质的性质越稳定
C. 破坏化学键时消耗能量,而形成化学键时释放能量
D. 碘易升华,这与分子中I—I键的键能大小有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com