
分析 (1)反应物总能量大于生成物总能量时,该反应为放热反应;放热反应中,断裂旧键吸收的总能量小于形成新键放出总能量,焓变为负值;
(2)①N2和H2完全反应生成1molNH3放热46.1kJ热量,则生成2mol氨气放热92.2kJ,依据热化学方程式书写原则解答;
②根据n=$\frac{m}{M}$计算出9gAl的物质的量,然后结合热化学方程式的书写原则写出其热化学方程式.
解答 解:(1)某化学反应,设反应物总能量为E1,生成物总能量为E2,若E1>E2,说明反应物总能量大于生成物总能量,该反应为放热反应;放热反应中,反应物断裂旧键吸收的总能量小于形成新键放出总能量,放热反应的焓变△H小于0,
故答案为:放;小于;小于;
(2)①14g氮气的物质的量为:$\frac{14g}{28g/mol}$=$\frac{1}{2}$mol,则该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.1kJ/mol,
故答案为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.1kJ/mol(或其他合理答案);
②9gAl的物质的量为:$\frac{9g}{27g/mol}$=$\frac{1}{3}$mol,该反应的化学方程式为:$\frac{1}{3}$Al(s)+$\frac{1}{2}$Cl2(g)=$\frac{1}{3}$AlCl3(s)△H=-274.2kJ/mol,
故答案为:$\frac{1}{3}$Al(s)+$\frac{1}{2}$Cl2(g)=$\frac{1}{3}$AlCl3(s)△H=-274.2kJ/mol (或其他合理答案).
点评 本题考查了反应热与焓变的应用、热化学方程式的书写,题目难度中等,明确热化学方程式的书写原则为解答关键,注意掌握反应热与焓变的关系及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO2 | C. | N2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 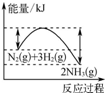 如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. | 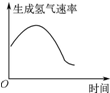 如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. | 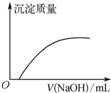 如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 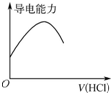 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应是吸热反应,则A为气态 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 改变压强对平衡的移动无影响 | |
| D. | 在平衡体系中加入少量C,则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2912 kJ | B. | 2953 kJ | C. | 3236 kJ | D. | 3836 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com