
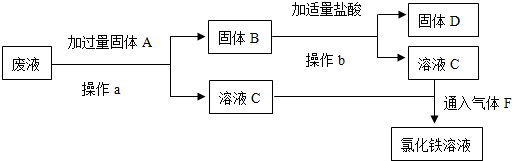
分析 (1)防止食品被氧气氧化,则防腐剂应具有还原性;
(2)Fe3+转化为Fe2+为被还原的过程;
(3)为防止硫酸亚铁被氧化,糖衣起到隔绝空气的作用;
(4)FeCl3溶液是否都转化为FeCl2了可以验证铁离子的存在设计实验验证.
解答 解:(1)防止食品被氧气氧化,则防腐剂应具有还原性,故答案为:还原性;
(2)Fe3+转化为Fe2+为被还原的过程,则维生素C起到还原剂的作用,具有还原性,故答案为:还原作用;
(3)Fe2+具有还原性,能被空气中的氧气氧化,为防止硫酸亚铁被氧化,糖衣起到隔绝空气的作用,
故答案为:防止Fe2+被空气中的氧气氧化;
(4)(1)FeCl3溶液是否都转化为FeCl2了,取少量溶液于试管中,滴入硫氰酸钾溶液若溶液变红色证明含铁离子,氯化铁未全部转化,若滴入后无红色出现,说明FeCl3溶液都转化为FeCl2,
故答案为:取少量溶液于试管中,滴入硫氰酸钾溶液若溶液变红色证明含铁离子,氯化铁未全部转化,若滴入后无红色出现,说明FeCl3溶液都转化为FeCl2;
点评 本题考查氧化还原反应,侧重于化学与生活、生产的考查,有利于培养学生的良好科学素养和提高学习的积极性,注意从元素化合价的角度理解相关概念和物质的性质,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:实验题
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是一种单质 | B. | 一定是纯净物 | ||
| C. | 可能是混合物也可能是纯净物 | D. | 一定是同位素组成的不同单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Te>H2Se>H2S>H2O | B. | KCl>NaCl>LiCl>HCl | ||
| C. | Sr>Ba>Ca>Be | D. | 金刚石>SiC>晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上将NH3与CO2在高温高压下制成[CO(NH2)2] | |
| B. | 空气中的O2和N2在闪电时化合成NO | |
| C. | 豆科植物的根瘤菌把氮气变为NH3 | |
| D. | 工业上用N2和H2来合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②⑤⑥ | C. | ②⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
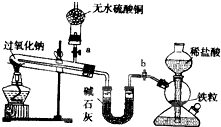 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为192 | B. | 中子数为77 | C. | 质量数为115 | D. | 电子数为77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com