
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

分析 (1)根据氧化剂氧化性强于氧化产物的氧化性进行判断;KBrO3溶液与KBr溶液在酸性条件下,发生类似信息反应③的反应,BrO3-、Br-在酸性条件下生成溴单质与水;
(2)先发生①BrO3-+6I-+6H+=3I2+Br-+3H2O,0.006molI-完全反应生成0.003molI2、0.001molBr-,消耗0.001molBrO3-,再发生反应BrO3-+5Br-+6H+=3Br2+3H2O,0.001molBr-完全反应消耗0.0002molBrO3-,最后发生反应②2BrO3-+I2=2IO3-+Br2,0.003molI2完全反应生成0.006molIO3-,消耗0.006molBrO3-,据此作图.
解答 解:(1)由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性BrO3->IO3->Br2>I2;
BrO3-、Br-在酸性条件下生成溴单质与水,反应离子方程式为:BrO3-+5Br-+6H+=3Br2+3H2O,
故答案为:BrO3->IO3->Br2>I2;BrO3-+5Br-+6H+=3Br2+3H2O;
(2)先发生①BrO3-+6I-+6H+=3I2+Br-+3H2O,0.006molI-完全反应生成0.003molI2、0.001molBr-,消耗0.001molBrO3-,
再发生反应BrO3-+5Br-+6H+=3Br2+3H2O,0.001molBr-完全反应消耗0.0002molBrO3-,
最后发生反应②2BrO3-+I2=2IO3-+Br2,0.003molI2完全反应生成0.006molIO3-,消耗0.006molBrO3-,
故整个过程中含碘物质的物质的量,随加入KBrO3的物质的量的关系图为: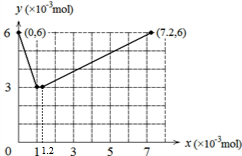
故答案为: .
.
点评 本题考查氧化还原反应及计算、对信息的利用,题目难度中等,是对学生综合能力的考查,学生溶液忽略滴加过程中BrO3-氧化Br-的反应.


科目:高中化学 来源: 题型:选择题
| A. | N2和H2的总能量一定大于NH3的总能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | N2和H2的总能量一定低于NH3的总能量 | |
| D. | NH3的能量一定高于N2的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
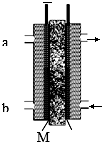 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 据图可知,阳极反应式为2SO42--4e-=2SO3↑+O2↑ | |
| B. | 阳极失去2mol电子时,理论上可以得到11.2L氧气 | |
| C. | SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-=SO42- | |
| D. | CO2不参与电极反应,净化器中CO2浓度升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
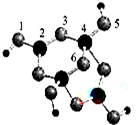 回答以下问题:
回答以下问题:| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
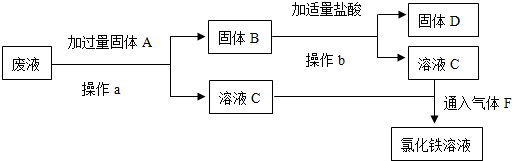
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com