
����Ŀ��ijʵ��С����0.55mol/LNaOH��Һ��0.50mol/LHCl��Һ�����к��ȵIJⶨ���ⶨ�к��ȵ�ʵ��װ����ͼ��ʾ��

(1)��ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ�������__________��
(2)ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50mL0.50mol/LHCl��Һ��50mL0.55mol/LNaOH��Һ��С�ձ��н����кͷ�Ӧ��ʵ�����������
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ(t2-t1)/�� | ||
HCl | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______�� |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
������д���еĿհף��¶Ȳ�ƽ��ֵ__________��
������ʵ����ֵ������к���57.3kJ/molƫС��������ԭ�������______��(����ĸ)
a.ʵ��װ�ñ��¡�����Ч����
b.��ȡNaOH��Һ�����ʱ���Ӷ���
c.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d.���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨHCl��Һ���¶�
(3)ʵ��������60mL0.25mol/LH2SO4��Һ��50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������______(���ȡ���������ȡ�)�������к���______(���ȡ���������ȡ�)������50mL0.50mol/L�������HCl��Һ��������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��______(�ƫ����ƫС����������Ӱ�족)
���𰸡����β�������� 3.4 acd ����� ��� ƫС
��������
����к��ȵĸ�����к���ʵ�������Ҫ�㱣�£���ֹ����ɢʧ�����жϣ��к���ָǿ���ǿ���ϡ��Һ�����кͷ�Ӧ����1molˮʱ�ų����ȣ����������Լ�������Ķ����أ�����������ʵĵ���ʱ���ȹ��̡�
(1)�����ȼƵĹ����֪��װ��ȱ�ٵ�һ�������ǻ��β����������
(2)�ٵ�1���¶Ȳ�Ϊ29.5��-26.1��=3.4�棬��2���¶Ȳ�Ϊ33.3��-27.2��=6.1�棬��3���¶Ȳ�Ϊ29.2��-25.9��=3.3�棬��4���¶Ȳ�Ϊ29.8��-26.3��=3.5�棬���е�2�������������ϴ���ȥ��ʣ��3�ε�ƽ���¶�Ϊ3.4�棻
��a��װ�ñ��¡�����Ч�����õ�����ƫС���к��ȵ���ֵƫС����a���ܣ�
b����ȡNaOH��Һ�����ʱ���Ӷ������ᵼ�������������������ƫ�ų�������ƫ�ߣ��к��ȵ���ֵƫ��b�����ܣ�
c������һ�ο��ٽ�NaOH��Һ����ʢ�������С�ձ��У��������ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У������ᵼ������ɢʧ���ⶨ��ֵƫС����c���ܣ�
d���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳ���ϡHCl���¶ȣ��������ʼ�¶�ƫ�ߣ���õ�����ƫС���к��ȵ���ֵƫС����d���ܣ�
�ʴ�Ϊ��acd��
(3)����60mL 0.25molL-1 H2SO4��Һ��50mL 0.55molL-1 NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������ȣ������ų�������Ҳ����ȣ������к���ָǿ���ǿ���ϡ��Һ��Ӧ����1molˮʱ�ų����ȣ����к�����ȣ����������ᣬ����������ȣ�������50mL0.50molL-1������������������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A.ϡ���������ԣ������ڳ�ȥ����
B.Al2O3�������ԣ������ڵ��ұ����
C.SO2��ʹ���Ը��������Һ��ɫ��������Ư����ɫ����
D.��ȩ��Һ��ʹ�����ʷ������ԣ������ڶ���걾�ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�úͷ���������Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ���
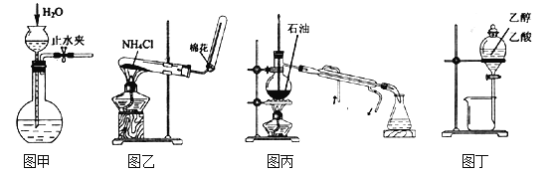
A. ��ͼ����ʾ�������װ�õ�������
B. ��ͼ����ʾװ����ȡ����
C. ��ͼ����ʾװ�÷���ʯ�ͻ������
D. ��ͼ����ʾװ�÷����Ҵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2����Al3����NH4+��CO32-��SO32����SO42����Cl���е������֣���ȡX��Һ��������ʵ�飬ʵ����̼��������£�
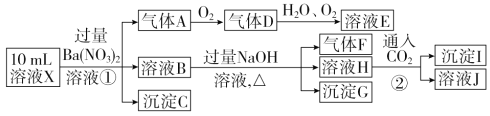
����˵����ȷ����
A. X��һ������Fe2����Al3����NH4+��SO42��
B. ��ҺE������F�ܷ�����ѧ��Ӧ
C. X�п϶�������CO32����SO32����Al3��
D. ����Iֻ��Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������¼����л��
��CH4��CH3CH2OH��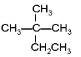 �ܹ����CH2=CH2��
�ܹ����CH2=CH2��![]() ��
��![]() ��
��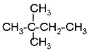 �����
�����
������������������ʰ�Ҫ��ش��������⣺
��1����Է�������Ϊ44�������Ľṹ��ʽΪ_____________������Ϊ_____________��ϵ��
��2����ۻ�Ϊͬ���칹�����_____________������ţ���
��3����120�棬1.01��105Pa�����£�ij����̬����������O2��ȫ��Ӧ��÷�Ӧǰ����������û�з����ı䣬�������_____________������ţ���
��4���á�������ʾ�٢ۢܢ��۷е�ߵ�˳��_____________������ţ���
��5������������ζ��������ȡ�����л����ڴ�������������Һ�巢����Ӧ�Ļ�ѧ����ʽ_____________��
��6���л�����ڼ��������º�CuO��Ӧ�Ļ�ѧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ��Ƴɷ��к���������ͪ�����ʡ��ӷ��͡��л��ӡ����ǵ�����ɷ֣�����һ���л��ӵĽṹ��ʽ��ͼ������˵����ȷ���� ( )
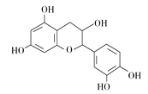
A. ����������̼ԭ�ӿ��Դ���ͬһƽ��
B. ����ʽΪC15H12O7
C. 1 mol���л��������Ũ��ˮ��Ӧ���������5 mol Br2
D. 1 mol���л�����NaOH��Һ��Ӧ�������5 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��3.01��1023��NH4+�������ӵ����ʵ�����____ �����е��ӵ����ʵ�����_____��
��2��200mL 2mol/L��Al2(SO4)3��Һ��SO42�������ʵ���Ũ��Ϊ_____ ��
��3����״���£�36g H2��O2��ɵĻ������������67.2L������������H2��O2�������Ϊ______��
��4����״���£���33.6LNH3����ˮ���500mL��Һ������Һ�����ʵ���Ũ��Ϊ____��
��5����֪1.505��1023��A������ӵ�����Ϊ31g����A�����Ħ��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�����ѧ��������Ϊ�����Ķ���Ŷӣ��з����˸�Ч������(��FeC��Fe2C��Fe5C2��Fe3C)���кϳɴ�������H2��COΪԭ�Ͽɸ߲��ʺϳ�ϩ������������3CO(g)+ 6H2(g)![]() CH3CH=CH2(g)+3H2O(g)��nCO+(2n+1)H2
CH3CH=CH2(g)+3H2O(g)��nCO+(2n+1)H2![]() CnH2n+2+nH2O��Ϊú��������Һ��ʹ�ÿ�������;����
CnH2n+2+nH2O��Ϊú��������Һ��ʹ�ÿ�������;����
(1)Fe3+��������ߵ��ܼ��ϵĵ�������_____����չ����λ�ڲ�ͬ�������˶��ĵ��ӵ�������С��ϵ��_________����Feԭ�ӵ����Ų���[Ar]3d64s2��[Ar]3d64s14p1ʱ����ϵ������_______(����������������С��)��
(2)Fe��C��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_____________��CH3CH=CH2������̼ԭ�ӵ��ӻ��������Ϊ____�����������Ӧ��CO�����ж��ѵĻ�ѧ������Ϊ______(����ĸ)��
A. 2��������1������ B. 1��������2������ C. �Ǽ��Լ�
(3)������[(CH3)4C]������5��̼ԭ���γɵĿռ乹����____________���÷�����________(���������������Ǽ�����)���ӡ�������������̼ԭ����Ŀ�����ӣ�ͬϵ��ķе�����.��ԭ����__________��
(4)̼��֮����γɶ��ֻ��������һ�ֻ�����ľ���ṹ(���������ṹ)��ͼ��ʾ��

����Ϊ�ٵ�ԭ�ӵ�����Ϊ_______________���û�����Ļ�ѧʽΪ_______________����þ���ľ�������Ϊa pm�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ_______________ g��cm-3(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ��(��10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)�����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����____________(����ĸ���)��
A��![]() (NH3)��2
(NH3)��2![]() (CO2) B���ܱ���������ѹǿ����
(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���D���ܱ����������ƽ��Ħ����������
(2)���ݱ������ݣ���ʽ����25.0��ʱ�ķֽ�ƽ�ⳣ��____________��
(3)ȡһ�����İ�������粒������һ�����������ܱ���������У���25���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�����������ƽ��ʱ������Ũ��____________(����ӡ�������С�����䡱)��
(4)��������立ֽⷴӦ���ʱ���H____________0���ر���S____________0(�>������������<��)�÷�Ӧ��____________���������������Է����С�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com