
【题目】傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)

下列说法错误的是
A. 一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷![]() 互为同分异构体
互为同分异构体
B. b的二氯代物超过三种
C. R为C5H11时,a的结构有3种
D. R为C4H9时,1molb加成生成C10H20至少需要3molH2
【答案】C
【解析】
A.环己烯![]() 分子式为C6H10,螺[2.3]己烷
分子式为C6H10,螺[2.3]己烷![]() 分子式为C6H10,所以互为同分异构体,故A正确;
分子式为C6H10,所以互为同分异构体,故A正确;
B.若全部取代苯环上的2个H原子,若其中1个Cl原子与甲基相邻,另一个Cl原子有如图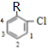 所示4种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图
所示4种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图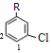 所示2种取代位置,有2种结构,若考虑烃基上的取代将会更多,故B正确;
所示2种取代位置,有2种结构,若考虑烃基上的取代将会更多,故B正确;
C.若主链有5个碳原子,则氯原子有3种位置,即1-氯戊烷、2-氯戊烷和3-氯戊烷;若主链有4个碳原子,此时甲基只能在2号碳原子上,而氯原子有4种位置,分别为2-甲基-1-氯丁烷、2-甲基-2-氯丁烷、3-甲基-2-氯丁烷和3-甲基-1-氯丁烷;若主链有3个碳原子,此时该烷烃有4个相同的甲基,因此氯原子只能有一种位置,即2,3-二甲基-1-氯丙烷。综上所叙分子式为C5H11Cl的同分异构体共有8种,故C错误;
D.-C4H9已经达到饱和,1mol苯环消耗3mol氢气,则lmol b最多可以与3mol H2加成,故D正确。
答案:C


科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为__________反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是______________(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃ 时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2
和xmolH2,则:
当x=5.0时,上述平衡向____________(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
② 若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b% ,则a _________ b (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图。请回答下列问题:

(1)写出基态Cu的外围电子排布式_____________________________________。
(2)配体氨基乙酸根(H2NCH2COOˉ)受热分解可产生CO2和N2,N2中σ键和π键数目之比是__________;N2O与CO2互为等电子体,则N2O的电子式为____________。
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醛分子中HCO的键角_____(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在如图中表示出来_____。

(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;

(5)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为______。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A.2∶1B.1∶2C.1∶7D.1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子树脂具有较好的吸水性,其合成线路如下:

已知:I:-CHO+-CH2CHO![]() -CH=CHCHO
-CH=CHCHO
II. -CH=CH-COOH
-CH=CH-COOH
回答下列问题
(1)G中的含氧官能团名称为______,M的结构简式为_______。
(2)由A生成B的化学方程式为______________________。
(3)上述合成路线中,D→E的转化在合成M中的作用为_________________。
(4)下列选项中对有机物F的性质推测正确的是_______________________。(填字母)
A. 1mol F与足量NaHCO3溶液反应放出2molCO2
B. 能发生水解反应和消去反应
C. 能聚合成高分子化合物
D. 1 mol F最多消耗3 mol NaOH
(5)符合下列条件的G的同分异构体有________种
A.属于芳香族化合物,且只有1种官能团
B.能发生银镜反应
C.除苯环外不存在其他环状结构
其中核磁共振氢谐有4组峰的是________(写出其中一种的结构简式)
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选)设计制备 的合成路线______
的合成路线______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)欲将0.10 mol.L-1的NaOH溶液和0.60 mol.L-1的NaOH溶液混合成0.20 mol.L-1的NaOH溶液(忽略混合时溶液体积变化),则两种溶液的体积比为___________。
(2)某温度下,40g质量分数为10%硝酸钠溶液与60g质量分数为7.5%的硝酸钠溶液混合,得到密度为1.20 g.cm-3的混合溶液,则该混合溶液中NaNO3的物质的量浓度为______。
(3)现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL二氧化碳气体(在标准状况下)。则原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用2.0mol/LNaCl溶液配制100mL0.50mol/LNaCl溶液,需要量取2.0mol/LNaCl溶液。
(1)配制上述溶液除需要玻璃棒、滴定管(用于测量2.0mol/LNaCl溶液体积)外,还需要的仪器有___、___、___。
(2)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”):
①没有洗涤烧杯和玻璃棒。___。
②定容时俯视容量瓶的刻度线。___。
③如果加水超过了刻度线,取出部分水使液面恰好达到刻度线。___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com