
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
【答案】酸 CrO42- 增大 NH4Cl ① NH4Cl和NH3·H2O 小于 B 1.2×10-3 mol·L-1
【解析】
Ⅰ.针对平衡Cr2O72-+H2O ![]() 2HCrO4-
2HCrO4- ![]() 2CrO42-+2H+,根据平衡移动规律进行分析判断;
2CrO42-+2H+,根据平衡移动规律进行分析判断;
Ⅱ.根据只存在OH-、H+、NH4+、Cl-四种离子电解质溶液,可能存在的溶质为:NH4Cl、NH4Cl和HCl、和NH4Cl和NH3H2O进行分析判断;利用电荷守恒规律处理问题(3)。
III.已知溶度积越小越易转化为沉淀,根据表格中的数据进行判断;先根据pH=8.0可得c(H+)=10-8mol·L-1,计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)= Ksp /c(OH_)2进行计算。
Ⅰ.(1)重铬酸钾(K2Cr2O7)溶液中重铬酸离子在水中存在如下平衡:Cr2O72﹣+H2O![]() 2HCrO4﹣
2HCrO4﹣![]() 2CrO42﹣+2H+,导致溶液中的氢离子的浓度大于氢氧根离子的浓度,溶液呈酸性;在强碱溶液中,氢离子浓度减小,该平衡Cr2O72﹣+H2O
2CrO42﹣+2H+,导致溶液中的氢离子的浓度大于氢氧根离子的浓度,溶液呈酸性;在强碱溶液中,氢离子浓度减小,该平衡Cr2O72﹣+H2O![]() 2HCrO4﹣
2HCrO4﹣![]() 2CrO42﹣+2H+正向移动,所以在强碱溶液中,铬元素的主要存在形式为CrO42﹣;向重铬酸钾溶液中加入适量稀硫酸,氢离子的浓度增大,平衡逆向移动,溶液中c(Cr2O72﹣)/c(CrO42﹣)的比值增大;
2CrO42﹣+2H+正向移动,所以在强碱溶液中,铬元素的主要存在形式为CrO42﹣;向重铬酸钾溶液中加入适量稀硫酸,氢离子的浓度增大,平衡逆向移动,溶液中c(Cr2O72﹣)/c(CrO42﹣)的比值增大;
综上所述,本题答案是:酸 , CrO42- ,增大。
Ⅱ.(1)溶液中只存在OH-、H+、NH4+、Cl-四种离子,可能为NH4Cl溶液,因NH4+水解而显酸性,溶液中离子浓度大小顺序为: c(Cl-)>c(NH4+)>c(H+)>c(OH-), ①正确;综上所述,本题答案是:NH4Cl;①。
(2)若上述关系中是③正确的,溶液呈碱性,且c(Cl-)<c(NH4+),应为NH3H2O和NH4Cl的混合物;综上所述,本题答案是:NH4Cl和NH3·H2O。
(3) 溶液呈中性,据电荷守恒:c(Cl-)+ c(H+)= c(OH-)+ c(NH4+),可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,即 c(HCl)小于 c(NH3·H2O) ;
综上所述,本题答案是:小于。
III.(1) 溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,B正确;综上所述,正确答案是:B。
(2)由Pb(OH)2的溶度积为1.2×10-15,pH=8.0,c(OH-)=10-6mol·L-1,则c(Pb2+)= Ksp /c(OH-)2=1.2×10-15/(10-6)2=1.2×10-3mol·L-1;
综上所述,本题答案是:1.2×10-3mol·L-1。


科目:高中化学 来源: 题型:
【题目】了解用药常识,有利于自我保健。现有下列药物:a.阿司匹林(乙酰水杨酸)b.青霉素 c.抗酸药(氢氧化铝)d.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是________
②治疗胃酸过多,但患有严重的胃溃疡,应该选择________
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物中符合要求的官能团的名称。
(1)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如下所示:
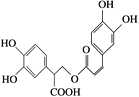
该物质中含有的官能团有________________。
(2)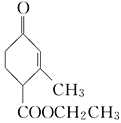 中含有的官能团是____________。
中含有的官能团是____________。
(3)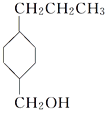 中含有的官能团是____________。
中含有的官能团是____________。
(4)![]() 中显酸性的官能团是________________,另一官能团是________________。
中显酸性的官能团是________________,另一官能团是________________。
(5) 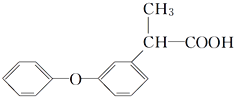 中含氧官能团是________________。
中含氧官能团是________________。
(6)![]() 中不含氧原子的官能团是________________。
中不含氧原子的官能团是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于解释下列现象的化学用语表述正确的是( )
A. 硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 亚硫酸溶液呈酸性:H2SO3===2H++SO32-
C. 氯化铝溶液跟过量的氨水反应:Al3++4OH-===[Al(OH)4]-
D. FeCl3溶液呈酸性:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A. Na+、Ba2+、Cl-、SO42- B. H+、NH4+、CO32-、SO42-
C. K+、Na+、NO3-、OH- D. H+、Cl-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
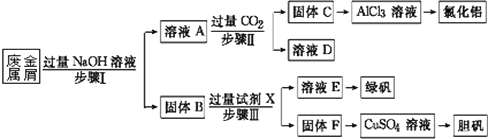
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ中Al与NaOH溶液反应的离子方程式_________。
(2)试剂X是_______;固体F是______。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生
的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加一个盛有饱和____溶液的洗气瓶,其作用是______。

(4)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
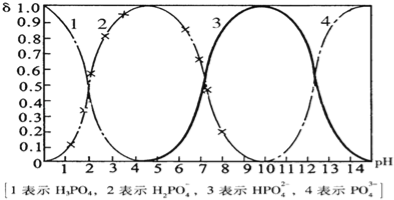
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 .
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(4)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中国传统文化的瑰宝。铜墙铁壁、铜心铁胆、金戈铁马、百炼成钢等成语向人传递正能量。工业上,冶炼铁的有关热化学方程式如下:①C(s)+O2(g)=CO2(g) △H1=akJ·mol-1;②CO2(g)+C(s)=2CO(g) △H2=bkJ·mol-1;③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H3=ckJ·mol-1;④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g )△H4=dkJ·mol-1(上述热化学方程式中,a,b,c,d均不等于0)。下列说法不正确的是( )
A. b>a
B. d=3b+2c
C. C(s)+![]() O2(g)=CO (g) △H=
O2(g)=CO (g) △H=![]() kJ·mol-1
kJ·mol-1
D. CO(g)+![]() O2(g)=CO2(g) △H<akJ·mol-1
O2(g)=CO2(g) △H<akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式可以用“键线式”表示,其中线表示键,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。已知利用某些有机物之间的转化可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为 (反应吸热),下列叙述中错误的是( )
(反应吸热),下列叙述中错误的是( )
A. NBD和Q互为同分异构体
B. Q可使溴水褪色
C. Q的一氯代物只有3种
D. NBD的同分异构体可以是芳香烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com