
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
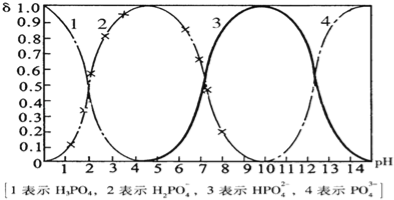
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 .
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(4)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
【答案】(1)c(总)=c(H3PO4)+c(H2PO4﹣)+c(HPO42﹣)+c(PO43﹣)
(2)HPO42﹣+H+═H2PO4﹣ H2PO4﹣、HPO42﹣
(3)酸 H2PO4﹣在溶液中的电离程度大于水解程度
(4)> KOH抑制了PO43﹣的水解
【解析】
试题(1)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,根据P原子守恒,c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-),
(2)根据图象知,当向溶液中滴加稀盐酸时,溶液中H2PO4-增加,HPO42-减少,所以是溶液中的HPO42-和氢离子发生生成H2PO4-,离子方程式为:HPO42-+H+═H2PO4-,当pH=7时,根据图象知,溶液中存在的阴离子为H2PO4-、HPO42-;
(3)根据图象可知,当溶液中存在H2PO4-时,溶液呈酸性,说明H2PO4-在溶液中的电离程度大于水解程度,导致溶液中氢离子浓度大于氢氧根离子的浓度,答案为:酸;H2PO4-在溶液中的电离程度大于水解程度;
(4)磷酸钠是强碱弱酸盐,弱酸根离子能发生水解,导致溶液中c(Na+)/c(PO43-)>3; PO43-+H2O![]() HPO42-+OH-,当向溶液中滴入几滴浓KOH溶液后,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,c(Na+)/c(PO43-)的值减小,答案为:>;KOH抑制了PO43-的水解.
HPO42-+OH-,当向溶液中滴入几滴浓KOH溶液后,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,c(Na+)/c(PO43-)的值减小,答案为:>;KOH抑制了PO43-的水解.


科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物![]() 请回答下列问题:
请回答下列问题:

(1)冷凝管所起的作用为冷凝回流蒸气,冷凝水从 ____![]() 填“a”或“b”
填“a”或“b”![]() 口进入。
口进入。
(2)实验开始时,关闭![]() 、开启
、开启![]() 和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,III中小试管内苯的作用是__________ 。
和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,III中小试管内苯的作用是__________ 。
(3)能说明苯与液溴发生了取代反应的现象是_____________ ;若把III中洗气瓶内的硝酸银溶液换为 ______![]() 填试剂名称
填试剂名称![]() ,当出现______________ 现象也能说明发生取代反应。
,当出现______________ 现象也能说明发生取代反应。
(4)四个实验装置中能起到防倒吸的装置有_________________ 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
![]() 用蒸馏水洗涤,振荡,分液;
用蒸馏水洗涤,振荡,分液;![]() 用
用![]() 的NaOH溶液洗涤,振荡,分液;
的NaOH溶液洗涤,振荡,分液;![]() 用蒸馏水洗涤,振荡,分液;
用蒸馏水洗涤,振荡,分液;![]() 加入无水氯化钙干燥;
加入无水氯化钙干燥;![]() ______
______![]() 填操作名称
填操作名称![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:氢氧化钠、金刚石、硫化钾、干冰,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是( )
A.①②②③B.②①②③C.②③②①D.①①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务。下列举措不符合这一要求的是 ( )
A.倡导开私家车的人乘公交车上下班B.国家减免小排量轿车的购置税
C.政府鼓励科研和生产部门开发、利用太阳能D.加快开发石油以缓解能源紧张问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
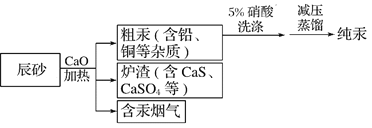
A. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
B. HgS+O2![]() Hg+SO2属于置换反应
Hg+SO2属于置换反应
C. 含汞烟气必须处理达标后才能排放
D. 流程中加入氧化钙的目的是减少SO2的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com