
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物![]() 请回答下列问题:
请回答下列问题:

(1)冷凝管所起的作用为冷凝回流蒸气,冷凝水从 ____![]() 填“a”或“b”
填“a”或“b”![]() 口进入。
口进入。
(2)实验开始时,关闭![]() 、开启
、开启![]() 和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,III中小试管内苯的作用是__________ 。
和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,III中小试管内苯的作用是__________ 。
(3)能说明苯与液溴发生了取代反应的现象是_____________ ;若把III中洗气瓶内的硝酸银溶液换为 ______![]() 填试剂名称
填试剂名称![]() ,当出现______________ 现象也能说明发生取代反应。
,当出现______________ 现象也能说明发生取代反应。
(4)四个实验装置中能起到防倒吸的装置有_________________ 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
![]() 用蒸馏水洗涤,振荡,分液;
用蒸馏水洗涤,振荡,分液;![]() 用
用![]() 的NaOH溶液洗涤,振荡,分液;
的NaOH溶液洗涤,振荡,分液;![]() 用蒸馏水洗涤,振荡,分液;
用蒸馏水洗涤,振荡,分液;![]() 加入无水氯化钙干燥;
加入无水氯化钙干燥;![]() ______
______![]() 填操作名称
填操作名称![]()
【答案】a 吸收溴蒸气 III中硝酸银溶液内有浅黄色沉淀生成 石蕊 溶液变红 III、IV 蒸馏
【解析】
实验原理为:溴与苯在铁丝催化下剧烈反应,放出大量热,此时由于K1打开,溴蒸汽和反应得到的HBr到了Ⅲ,溴溶于苯,HBr与硝酸银反应得到沉淀。剩余的HBr被NaOH吸收。
实验原理为:溴与苯在铁丝催化下剧烈反应,放出大量热,此时由于K1打开,溴蒸汽和反应得到的HBr到了Ⅲ,溴溶于苯,HBr与硝酸银反应得到沉淀。剩余的HBr和溴被NaOH吸收。
(1)冷凝水从a口进入,采用逆流操作,冷却更充分;
(2)因该实验的目的是要探究苯与溴发生反应的原理,若为加成反应,则无HBr生成,而取代反应有,通过III中硝酸银溶液内是否出现淡黄色沉淀来证明反应为取代反应还是加成反应。由于溴化氢气体中可能混有一定量的溴蒸气,溴易溶于苯而溴化氢不溶,故需先通过苯吸收溴蒸气,排除溴蒸气对实验的干扰;
(3)能说明苯与液溴发生了取代反应的现象是III中硝酸银溶液内出现淡黄色沉淀;若把III中洗气瓶内的硝酸银溶液换为石蕊,由于溴化氢溶于水使溶液显酸性,故当出现溶液变红现象也能说明发生取代反应;
(4)四个实验装置中能起到防倒吸的装置有III、IV;
(5)利用苯与溴苯之间的沸点差异,可以采取蒸馏的方法将两者分离,故⑤为蒸馏。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q是原子序数依次增大的五种短周期元素,X是原子半径最小的元素,Y的气态氢化物能与其最高价氧化物的水化物反应生成盐,Z为地壳中含量最多的元素,R的单质在CO2燃烧生成两种固体,Y、Z、Q的最外层电子数之和为18。请回答下列问题:
(1)Z在元素周期表中的位置为__________。
(2)Z、R、Q离子半径从大到小的顺序为__________。(填离子符号);
(3)X、Z两元素形成的原子个数比为1:1的化合物的电子式为__________。
(4)R3Y2与水可剧烈反应,产生沉淀和气体,反应的化学方程式为__________。
(5)元素Y与X形成一种离子YX4+,请写出检验溶液中该离子的实验操作、现象和结论__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解用药常识,有利于自我保健。现有下列药物:a.阿司匹林(乙酰水杨酸)b.青霉素 c.抗酸药(氢氧化铝)d.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是________
②治疗胃酸过多,但患有严重的胃溃疡,应该选择________
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平![]() 请回答:
请回答:
(1)乙烯的结构式是______。
(2)写出乙烯在一定条件下生成聚乙烯塑料的化学方程式为______。
(3)可以用来除去乙烷中混有的乙烯的试剂是______(填序号![]()
①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液
(4)在一定条件下,乙烯能与水反应生成有机物A,A的结构简式是______,其反应类型是__________反应![]() 填“取代”或“加成”
填“取代”或“加成”![]() 。
。
(5)下列化学反应原理相同的是______![]() 填序号
填序号![]() 。
。
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②SO2使溴水和酸性高锰酸钾溶液褪色
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由分子组成的物质中一定存在共价键
B.由非金属元素组成的化合物一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.非金属元素的两个原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
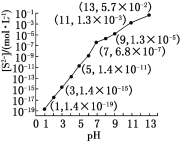
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物中符合要求的官能团的名称。
(1)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如下所示:
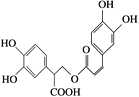
该物质中含有的官能团有________________。
(2)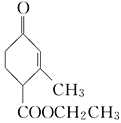 中含有的官能团是____________。
中含有的官能团是____________。
(3)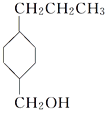 中含有的官能团是____________。
中含有的官能团是____________。
(4)![]() 中显酸性的官能团是________________,另一官能团是________________。
中显酸性的官能团是________________,另一官能团是________________。
(5) 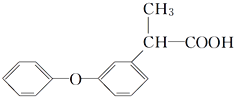 中含氧官能团是________________。
中含氧官能团是________________。
(6)![]() 中不含氧原子的官能团是________________。
中不含氧原子的官能团是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
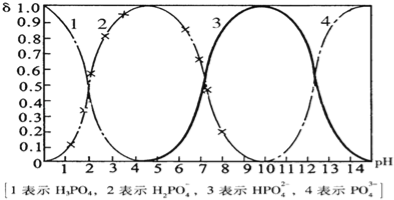
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 .
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 .
(4)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com