
ЁОЬтФПЁПЛЏКЯЮяHЪЧвЛжжЯуСЯЃЌДцдкгкН№щйжаЃЌПЩгУШчЯТТЗЯпКЯГЩЃК

ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉ11.2 LЃЈБъзМзДПіЃЉЕФЬўAдкбѕЦјжаГфЗжШМЩеПЩвдВњЩњ88g CO2КЭ45gH2OЁЃAЕФЗжзгЪНЪЧ___________ЁЃ
ЃЈ2ЃЉDЕФУћГЦЃЈЯЕЭГУќУћЃЉЮЊ____________________ЃЛ
ЃЈ3ЃЉдкДпЛЏМСДцдкЯТ1mol Fгы2 mol H2ЗДгІЃЌЩњГЩ3-БНЛљ-1-БћДМЃЌFЕФНсЙЙМђЪНЪЧ_______________ЃЛ
ЃЈ4ЃЉЗДгІЂйЕФЗДгІРраЭЪЧ___________________ЃЛ
ЃЈ5ЃЉЗДгІЂкЕФЛЏбЇЗНГЬЪНЮЊ___________________ЃЛ
ЃЈ6ЃЉгыGОпгаЯрЭЌЕФЙйФмЭХЕФЗМЯуРрЭЌЗжвьЙЙЬхга________жжЃЈВЛКЌGЃЉЃЌЦфжаHNMRжагаЮхзщЗхЃЌЗхУцЛ§БШЮЊ1ЁУ1ЁУ2ЁУ2ЁУ2ЕФвьЙЙЬхЕФНсЙЙМђЪНЃК___________________ ЁЃ
ЁОД№АИЁПC4H10 2-МзЛљБћЯЉ ![]() ЯћШЅЗДгІ (CH3)2CHCH2OH+
ЯћШЅЗДгІ (CH3)2CHCH2OH+![]()
![]()
![]() +H2O 4
+H2O 4 ![]()
ЁОНтЮіЁП
БОЬтЁАЭЛЦЦПкЁБдкгкЖдAЁЂBЁЂCЕФНсЙЙAЪЧЬўЃЌБъзМзДПіЯТ11.2LAЕФЮяжЪЕФСПЮЊ0.5molЃЌШМЩеЩњГЩ2mol CO2КЭ2.5molH2OЃЌИљОнШМЩеЗДгІжаЬМЁЂЧтдзгЪиКуЕУ1molAЗжзгжаКЌ4molCКЭ10molHЃЌAЕФЗжзгЪНЮЊC4H10ЁЃAЭЌЗжвьЙЙЬхгае§ЖЁЭщ(CH3CH2CH2CH3)КЭвьЖЁЭщ[(CH3CH(CH3)2]ЃЌдйДгвЛТШДњЮяЕФжжЪ§КЭвЛТШДњЮяЯћШЅЗДгІВњЮяНЧЖШЗжЮіЃЌAжЛФмЪЧвьЖЁЭщЁЃNaOHДМШмвКЪЧТБДњЬўЯћШЅЗДгІЕФЬѕМўЃЌЯћШЅВњЮяDдђЪЧ![]() ЃЌИљОнЁАвбжЊЃЈ2ЃЉЁБЕУEЪЧ(CH3)2CHCH2OHЁЃИљОн1molFгы2molH2МгГЩКѓВњЮяЃЈ3-БНЛљ-1-БћДМЃЉЕФЬММмвдМАFПЩгыЁАаТжЦCu(OH)2аќзЧвКЗДгІЁБШЗЖЈFЪЧ
ЃЌИљОнЁАвбжЊЃЈ2ЃЉЁБЕУEЪЧ(CH3)2CHCH2OHЁЃИљОн1molFгы2molH2МгГЩКѓВњЮяЃЈ3-БНЛљ-1-БћДМЃЉЕФЬММмвдМАFПЩгыЁАаТжЦCu(OH)2аќзЧвКЗДгІЁБШЗЖЈFЪЧ![]() ЃЌНјЖјШЗЖЈGЪЧ
ЃЌНјЖјШЗЖЈGЪЧ![]() ЃЌХЈСђЫсЬѕМўЯТE+GЁњHЗДгІдђЪЧѕЅЛЏЗДгІЃЌгЩДЫЗжЮіНтД№ЁЃ
ЃЌХЈСђЫсЬѕМўЯТE+GЁњHЗДгІдђЪЧѕЅЛЏЗДгІЃЌгЩДЫЗжЮіНтД№ЁЃ
(1)11.2LЃЈМД![]() =0.5molЃЉЕФЬўAжаКЌЬМдзг
=0.5molЃЉЕФЬўAжаКЌЬМдзг![]() ЃЌКЌЧтдзг
ЃЌКЌЧтдзг![]() ЃЌдђ1molAжаКЌЬМдзг2molЁТ0.5=4molЃЌКЌЧтдзг5molЁТ0.5=10molЃЌЫљвдAЕФЗжзгЪНЮЊC4H10ЁЃ
ЃЌдђ1molAжаКЌЬМдзг2molЁТ0.5=4molЃЌКЌЧтдзг5molЁТ0.5=10molЃЌЫљвдAЕФЗжзгЪНЮЊC4H10ЁЃ
(2)вђЮЊBЁЂCЖМЪЧAЕФвЛТШДњЬўЃЌдкNaOHДМШмвКжаЙВШШЗЂЩњЯћШЅЗДгІЩњГЩЭЌжжЮяжЪDЃЌЫЕУїBЁЂCЕФЬМСДЯрЭЌЃЌAЕФЗжзгЪНЮЊC4H10ЃЌAгаСНжжЭЌЗжвьЙЙЬхЃКе§ЖЁЭщЃЈCH3CH2CH2CH3ЃЉЁЂвьЖЁЭщ[CH3CH(CH3)2]ЃЌЦфжавьЖЁЭщЕФвЛТШДњЮяга2жжCH2ClCH(CH3)2ЁЂCH3CCl(CH3)2ЃЌЧвЯћШЅЗДгІЩњГЩЕФгаЛњВњЮяЖМЪЧ![]() ЃЌЫљвдDЕФНсЙЙМђЪНЮЊ
ЃЌЫљвдDЕФНсЙЙМђЪНЮЊ![]() ЃЌЯЕЭГУќУћЮЊЃК2-МзЛљБћЯЉЁЃ
ЃЌЯЕЭГУќУћЮЊЃК2-МзЛљБћЯЉЁЃ
(3)вђFПЩгыаТжЦCu(OH)2аќзЧвКЗДгІЃЌЙЪFЗжзгжаКЌгаШЉЛљЃЈ-CHOЃЉ,1molFгы2molH2МгГЩКѓЕФВњЮяЮЊ3-БНЛљ-1-БћДМЃЌЦфжа-OHгЩШЉЛљМгЧтЕУЕНЃЌЛЙга1molH2жЛФмЪЧ1mol>C=C<МгГЩЕУЕНЃЌЫљвдFЕФНсЙЙМђЪН![]() ЁЃ
ЁЃ
(4) ЗДгІЂйЪЧвЛТШДњвьЖЁЭщгыNaOHДМШмвКЙВШШЗЂЩњЯћШЅЗДгІЃЌЫљвдЗДгІРраЭЪЧЯћШЅЗДгІЁЃ
(5)ИљОнЩЯУцЗжЮіПЩжЊDЪЧ(CH3)2C=CH2ЃЌDЕНEЗћКЯЁАвбжЊ(2)ЁБЃЌдђE![]() ЃЌFЕНGЕФЙ§ГЬга2ВНЃКЯШЪЧШЉЛљБЛбѕЛЏЮЊєШЛљЕФФЦбЮЃЌШЛКѓєШЛљЕФФЦбЮБЛЫсЛЏЩњГЩєШЛљЃЌЫљвдGЕФНсЙЙМђЪНЮЊ
ЃЌFЕНGЕФЙ§ГЬга2ВНЃКЯШЪЧШЉЛљБЛбѕЛЏЮЊєШЛљЕФФЦбЮЃЌШЛКѓєШЛљЕФФЦбЮБЛЫсЛЏЩњГЩєШЛљЃЌЫљвдGЕФНсЙЙМђЪНЮЊ![]() ЃЌ(CH3)2CHCH2OHгы
ЃЌ(CH3)2CHCH2OHгы![]() дкХЈСђЫсзїгУЯТЗЂЩњѕЅЛЏЗДгІЃЌЫљвдЗДгІЂкЕФЛЏбЇЗНГЬЪНЮЊЃК(CH3)2CHCH2OH+
дкХЈСђЫсзїгУЯТЗЂЩњѕЅЛЏЗДгІЃЌЫљвдЗДгІЂкЕФЛЏбЇЗНГЬЪНЮЊЃК(CH3)2CHCH2OH+![]()
![]()
![]() +H2OЁЃ
+H2OЁЃ
(6)GЕФНсЙЙМђЪНЮЊ![]() ЃЌвђЫљаДЭЌЗжвьЙЙЬхЁАгыGОпгаЯрЭЌЕФЙйФмЭХЕФЗМЯуРрЁБЮяжЪЃЌМДЫљаДЭЌЗжвьЙЙЬхжаКЌвЛИіБНЛЗЁЂвЛИі>C=C<ЁЂвЛИі-COOHЃЌЯШНЋБНЛЗКЭ>C=C<зщКЯЃЌдйвдЁАЕШаЇЧтдзгЁБЕФЫМЯыСЌ-COOHЃЌ-COOHШЁДњЮЛжУШчЭМЃК
ЃЌвђЫљаДЭЌЗжвьЙЙЬхЁАгыGОпгаЯрЭЌЕФЙйФмЭХЕФЗМЯуРрЁБЮяжЪЃЌМДЫљаДЭЌЗжвьЙЙЬхжаКЌвЛИіБНЛЗЁЂвЛИі>C=C<ЁЂвЛИі-COOHЃЌЯШНЋБНЛЗКЭ>C=C<зщКЯЃЌдйвдЁАЕШаЇЧтдзгЁБЕФЫМЯыСЌ-COOHЃЌ-COOHШЁДњЮЛжУШчЭМЃК![]() ЃЌЦфжаЂйОЭЪЧGЃЌШчЙћВЛКЌGЙВга4жжЁЃЦфжаHNMRжагаЮхзщЗхЃЌЗхУцЛ§БШЮЊ1ЁУ1ЁУ2ЁУ2ЁУ2ЕФвьЙЙЬхЕФНсЙЙМђЪНЮЊ
ЃЌЦфжаЂйОЭЪЧGЃЌШчЙћВЛКЌGЙВга4жжЁЃЦфжаHNMRжагаЮхзщЗхЃЌЗхУцЛ§БШЮЊ1ЁУ1ЁУ2ЁУ2ЁУ2ЕФвьЙЙЬхЕФНсЙЙМђЪНЮЊ![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂRЁЂQЪЧдзгађЪ§вРДЮдіДѓЕФЮхжжЖЬжмЦкдЊЫиЃЌXЪЧдзгАыОЖзюаЁЕФдЊЫиЃЌYЕФЦјЬЌЧтЛЏЮяФмгыЦфзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЗДгІЩњГЩбЮЃЌZЮЊЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЌRЕФЕЅжЪдкCO2ШМЩеЩњГЩСНжжЙЬЬхЃЌYЁЂZЁЂQЕФзюЭтВуЕчзгЪ§жЎКЭЮЊ18ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)ZдкдЊЫижмЦкБэжаЕФЮЛжУЮЊ__________ЁЃ
(2)ZЁЂRЁЂQРызгАыОЖДгДѓЕНаЁЕФЫГађЮЊ__________ЁЃ(ЬюРызгЗћКХ)ЃЛ
(3)XЁЂZСНдЊЫиаЮГЩЕФдзгИіЪ§БШЮЊ1:1ЕФЛЏКЯЮяЕФЕчзгЪНЮЊ__________ЁЃ
(4)R3Y2гыЫЎПЩОчСвЗДгІЃЌВњЩњГСЕэКЭЦјЬхЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
(5)дЊЫиYгыXаЮГЩвЛжжРызгYX4+ЃЌЧыаДГіМьбщШмвКжаИУРызгЕФЪЕбщВйзїЁЂЯжЯѓКЭНсТл__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПСђдЊЫиМАЦфЛЏКЯЮяЕФаджЪОпгаживЊвтвхЁЃ
(1)25 ЁцЃЌдк0.10 molЁЄLЃ1H2SШмвКжаЃЌЭЈШыHClЦјЬхЛђМгШыNaOHЙЬЬхвдЕїНкШмвКpHЃЌШмвКpHгы[S2Ѓ]ЙиЯЕШчЯТЭМ(КіТдШмвКЬхЛ§ЕФБфЛЏЁЂH2SЕФЛгЗЂ)ЁЃ
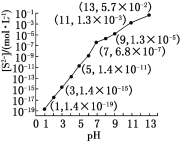
ЂйpHЃН13ЪБЃЌШмвКжаЕФ[H2S]ЃЋ[HSЃ]ЃН__________molЁЄLЃ1ЁЃ
ЂкФГШмвККЌ0.020 molЁЄLЃ1Mn2ЃЋЁЂ0.10 molЁЄLЃ1H2SЃЌЕБШмвКpHЃН____________ЪБЃЌMn2ЃЋПЊЪМГСЕэ[вбжЊЃКKsp(MnS)ЃН2.8ЁС10Ѓ13]ЁЃ
(2)25 ЁцЃЌСНжжЫсЕФЕчРыЦНКтГЃЪ§ШчЯТБэЁЃ
ЮяжЪ | Ka1 | Ka2 |
H2SO3 | 1.3ЁС10Ѓ2 | 6.3ЁС10Ѓ8 |
H2CO3 | 4.2ЁС10Ѓ7 | 5.6ЁС10Ѓ11 |
ЂйHSOЕФЕчРыЦНКтГЃЪ§БэДяЪНKЃН________ЁЃ
Ђк0.10 molЁЄLЃ1Na2SO3ШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ____________________ЁЃ
ЂлH2SO3ШмвККЭNaHCO3ШмвКЗДгІЕФжївЊРызгЗНГЬЪНЮЊ_________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаДГіЯТСагаЛњЮяжаЗћКЯвЊЧѓЕФЙйФмЭХЕФУћГЦЁЃ
(1)УдЕќЯуЫсЪЧДгЗфЛЈЪєжВЮяжаЬсШЁЕУЕНЕФЫсадЮяжЪЃЌЦфНсЙЙМђЪНШчЯТЫљЪОЃК
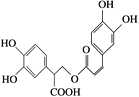
ИУЮяжЪжаКЌгаЕФЙйФмЭХга________________ЁЃ
(2)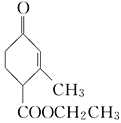 жаКЌгаЕФЙйФмЭХЪЧ____________ЁЃ
жаКЌгаЕФЙйФмЭХЪЧ____________ЁЃ
(3)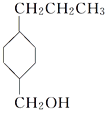 жаКЌгаЕФЙйФмЭХЪЧ____________ЁЃ
жаКЌгаЕФЙйФмЭХЪЧ____________ЁЃ
(4)![]() жаЯдЫсадЕФЙйФмЭХЪЧ________________ЃЌСэвЛЙйФмЭХЪЧ________________ЁЃ
жаЯдЫсадЕФЙйФмЭХЪЧ________________ЃЌСэвЛЙйФмЭХЪЧ________________ЁЃ
(5) 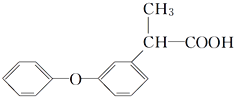 жаКЌбѕЙйФмЭХЪЧ________________ЁЃ
жаКЌбѕЙйФмЭХЪЧ________________ЁЃ
(6)![]() жаВЛКЌбѕдзгЕФЙйФмЭХЪЧ________________ЁЃ
жаВЛКЌбѕдзгЕФЙйФмЭХЪЧ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЪЧЮЛгкЖЬжмЦкЕФжїзхдЊЫиЁЃвбжЊЃКAЁЂBЁЂCЁЂEдкЭЌвЛжмЦкЃЌдкИУжмЦкдЊЫижаЃЌAЕФдзгАыОЖзюДѓЃЌBЕФРызгАыОЖзюаЁЃЛ AгыBжЪзгЪ§жЎКЭЪЧDжЪзгЪ§ЕФ3БЖЃЛC m- ЁЂE (m-1)- ОпгаЯрЭЌЕФЕчзгВуНсЙЙЃЛШШЮШЖЈадЃКH m DЃОH m CЁЃвРОнЩЯЪіаХЯЂгУЯргІЕФЛЏбЇгУгяЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉH m D m ЕФЕчзгЪНЮЊ____________________
ЃЈ2ЃЉC m- ЁЂE (m-1)- ЕФЛЙдадЧПШѕЫГађЮЊЃК_________ЃЌЃЈгУРызгЗћКХБэЪОЃЉФмжЄУїЦфЛЙдадЧПШѕЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЃЈ3ЃЉBЕЅжЪгыAЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК______________________ЁЃ
ЃЈ4ЃЉГЃЮТЯТЃЌНЋCD m ЭЈШыH m CШмвКжаЃЌгаCЮіГіЃЌаДГіИУЙ§ГЬЕФЛЏбЇЗНГЬЪН__________________ ЁЃ
ЃЈ5ЃЉдкAЁЂBЁЂCЁЂEЕЅжЪжаЃЌЗћКЯЯТСазЊЛЏЙиЯЕЕФЪЧ___________ЃЈЬюдЊЫиЗћКХЃЉЁЃ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУгкНтЪЭЯТСаЯжЯѓЕФЛЏбЇгУгяБэЪіе§ШЗЕФЪЧ(ЁЁЁЁ)
A. СђЛЏФЦШмвКГЪМюадЃКS2ЃЃЋ2H2O![]() H2SЃЋ2OHЃ
H2SЃЋ2OHЃ
B. бЧСђЫсШмвКГЪЫсадЃКH2SO3===2HЃЋЃЋSO32Ѓ
C. ТШЛЏТСШмвКИњЙ§СПЕФАБЫЎЗДгІЃКAl3ЃЋЃЋ4OHЃ===[Al(OH)4]Ѓ
D. FeCl3ШмвКГЪЫсадЃКFe3ЃЋЃЋ3H2O![]() Fe(OH)3ЃЋ3HЃЋ
Fe(OH)3ЃЋ3HЃЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщРызгдкШмвКжаПЩвдДѓСПЙВДцЕФЪЧЃЈ ЃЉ
A. Na+ЁЂBa2+ЁЂClЃЁЂSO42Ѓ B. H+ЁЂNH4+ЁЂCO32ЃЁЂSO42Ѓ
C. K+ЁЂNa+ЁЂNO3ЃЁЂOHЃ D. H+ЁЂClЃЁЂCH3COOЃЁЂNO3Ѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСзЫсЃЈH3PO4ЃЉдкШмвКжаФмЙЛвдH3PO4ЁЂH2PO4ЉЁЂHPO42ЉЁЂКЭPO43ЉЫФжжСЃзгаЮЪНДцдкЃЌЕБШмвКЕФpHЗЂЩњБфЛЏЪБЃЌЦфжаШЮвЛжжСЃзгЕФЮяжЪЕФСПеМЫФжжСЃзгзмЮяжЪЕФСПЕФЗжЪ§ІФвВПЩФмЗЂЩњБфЛЏЃЎЯТЭМЪЧH3PO4ШмвКжаЃЌИїжжСЃзгЕФЮяжЪЕФСПЗжЪ§ІФЫцpHЕФБфЛЏЧњЯпЃК
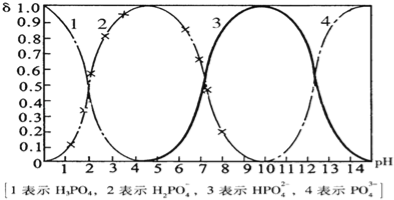
ЃЈ1ЃЉЩшСзЫсзмХЈЖШЮЊcЃЈзмЃЉЃЌаДГіcЃЈзмЃЉгыИїСЃзгХЈЖШМфЕФЙиЯЕЪН
ЃЈ2ЃЉЯђNa3PO4ШмвКжаж№ЕЮЕЮШыЯЁбЮЫсЃЌЕБpHДг9НЕЕН6ЕФЙ§ГЬжаЗЂЩњЕФжївЊЗДгІЕФРызгЗНГЬЪНЮЊ ЃЎЕБpH=7ЪБЃЌШмвКжажївЊДцдкЕФвѕРызгЃЈOHЉРызгГ§ЭтЃЉЪЧ ЃЎ
ЃЈ3ЃЉДгЭМжаЭЦЖЯNaH2PO4ШмвКГЪ адЃЈЬюЁАЫсЁБЁЂЁАМюЁБЁЂЛђЁАжаЁБЃЉЃЌЦфдвђЪЧ ЃЎ
ЃЈ4ЃЉдкNa3PO4ШмвКжаЃЌcЃЈNa+ЃЉ/cЃЈPO43-ЃЉ 3ЃЈЬюЁАЃОЁБЁЂЁАЈTЁБЁЂЛђЁАЃМЁБЃЉЃЛЯђИУШмвКжаЕЮШыМИЕЮХЈKOHШмвККѓЃЌcЃЈNa+ЃЉ/cЃЈPO43-ЃЉЕФжЕМѕаЁЃЌдвђЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪЪєгкРызгЛЏКЯЮяЕФЪЧЃЈ ЃЉ
A. N2
B. NH4Cl
C. H2O
D. H2SO4
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com