
【题目】下列各组离子在溶液中可以大量共存的是( )
A. Na+、Ba2+、Cl-、SO42- B. H+、NH4+、CO32-、SO42-
C. K+、Na+、NO3-、OH- D. H+、Cl-、CH3COO-、NO3-
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 36g由35Cl 和37C1组成的氯气中所含质子数一定为17NA
B. 7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA
C. 密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),增加了2NA个P-Cl键
D. 5.6g铁片投入足量浓硝酸中,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在NaOH的重水(D2O)溶液中加热水解,其产物是( )
A.C17H35COOD,CH2ODCHODCH2OD
B.C17H35COONa,CH2ODCHODCH2OD,HOD
C.C17H35COONa,CH2OHCHOHCH2OH,HOD
D.C17H35COONa,CH2ODCHODCH2OD,H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1 mol Fe与1 mol Cl2充分反应生成FeCl3时,转移电子数为3NA
B. 通常状况下,11.2 LH2所含的氢原子数为NA
C. 1 mol羟基与17 g NH3所含电子数之比为9∶10
D. 一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH![]() 的物质的量相同
的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务。下列举措不符合这一要求的是 ( )
A.倡导开私家车的人乘公交车上下班B.国家减免小排量轿车的购置税
C.政府鼓励科研和生产部门开发、利用太阳能D.加快开发石油以缓解能源紧张问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
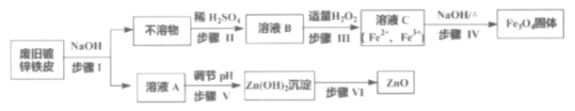
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤Ⅲ中反应的离子方程式是___________________________________。
(3)证明溶液B中含有Fe2+的方法是_________________________________。
(4)步骤Ⅴ可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- →Fe3O4(胶体)+S4O62-+H2O,若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com