
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 36g由35Cl 和37C1组成的氯气中所含质子数一定为17NA
B. 7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA
C. 密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),增加了2NA个P-Cl键
D. 5.6g铁片投入足量浓硝酸中,转移的电子数为0.3 NA
【答案】B
【解析】
假设全是35Cl,则质子数是![]() ,假设全是37Cl,则质子数是
,假设全是37Cl,则质子数是![]() ;Na2O2与足量酸性KMnO4溶液反应,Na2O2只作还原剂,过氧化钠中氧元素化合价由-1升高为0,1mol过氧化钠转移2mol电子;PCl3与Cl2反应制备PCl5的反应可逆;常温下,铁在浓硝酸中钝化。
;Na2O2与足量酸性KMnO4溶液反应,Na2O2只作还原剂,过氧化钠中氧元素化合价由-1升高为0,1mol过氧化钠转移2mol电子;PCl3与Cl2反应制备PCl5的反应可逆;常温下,铁在浓硝酸中钝化。
假设全是35Cl,则质子数是![]() ,假设全是37Cl,则质子数是
,假设全是37Cl,则质子数是![]() ,根据极值法,36g由35Cl 和37C1组成的氯气中所含质子数不一定为17NA,故A错误;Na2O2与足量酸性KMnO4溶液反应,Na2O2只作还原剂,过氧化钠中氧元素化合价由-1升高为0,1mol过氧化钠转移2mol电子 ,所以7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA,故B正确;PCl3与Cl2反应制备PCl5的反应可逆,密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),生成PCl5(g)小于1mol, P-Cl键增加小于2NA个,故C错误;常温下,铁在浓硝酸中钝化,故D错误,选B。
,根据极值法,36g由35Cl 和37C1组成的氯气中所含质子数不一定为17NA,故A错误;Na2O2与足量酸性KMnO4溶液反应,Na2O2只作还原剂,过氧化钠中氧元素化合价由-1升高为0,1mol过氧化钠转移2mol电子 ,所以7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA,故B正确;PCl3与Cl2反应制备PCl5的反应可逆,密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),生成PCl5(g)小于1mol, P-Cl键增加小于2NA个,故C错误;常温下,铁在浓硝酸中钝化,故D错误,选B。


科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
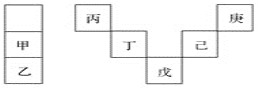
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q是原子序数依次增大的五种短周期元素,X是原子半径最小的元素,Y的气态氢化物能与其最高价氧化物的水化物反应生成盐,Z为地壳中含量最多的元素,R的单质在CO2燃烧生成两种固体,Y、Z、Q的最外层电子数之和为18。请回答下列问题:
(1)Z在元素周期表中的位置为__________。
(2)Z、R、Q离子半径从大到小的顺序为__________。(填离子符号);
(3)X、Z两元素形成的原子个数比为1:1的化合物的电子式为__________。
(4)R3Y2与水可剧烈反应,产生沉淀和气体,反应的化学方程式为__________。
(5)元素Y与X形成一种离子YX4+,请写出检验溶液中该离子的实验操作、现象和结论__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解用药常识,有利于自我保健。现有下列药物:a.阿司匹林(乙酰水杨酸)b.青霉素 c.抗酸药(氢氧化铝)d.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是________
②治疗胃酸过多,但患有严重的胃溃疡,应该选择________
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平![]() 请回答:
请回答:
(1)乙烯的结构式是______。
(2)写出乙烯在一定条件下生成聚乙烯塑料的化学方程式为______。
(3)可以用来除去乙烷中混有的乙烯的试剂是______(填序号![]()
①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液
(4)在一定条件下,乙烯能与水反应生成有机物A,A的结构简式是______,其反应类型是__________反应![]() 填“取代”或“加成”
填“取代”或“加成”![]() 。
。
(5)下列化学反应原理相同的是______![]() 填序号
填序号![]() 。
。
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②SO2使溴水和酸性高锰酸钾溶液褪色
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
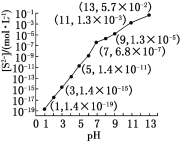
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A. Na+、Ba2+、Cl-、SO42- B. H+、NH4+、CO32-、SO42-
C. K+、Na+、NO3-、OH- D. H+、Cl-、CH3COO-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com