
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
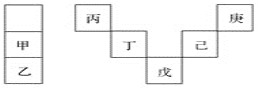
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
科目:高中化学 来源: 题型:
【题目】天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是

A. 当0<V≤33.6 L时,负极反应式为CH4+10OH--8e-== CO32-+7H2O
B. 正极反应式为O2 +4H+ +4e-==2H2O
C. 当V=67.2 L时,电池总反应方程式可写为CH4+2O2+NaOH== NaHCO3+2H2O
D. 电解质溶液中的Na+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
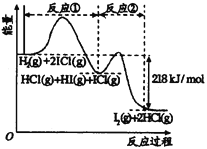
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
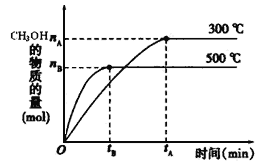
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)___________________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确

A. 放电时K+移向负极
B. 放电时电池负极的电极反应为H2-2e-===2H+
C. 放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D. 该电池充电时将碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、Na2 SO4 、KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 36g由35Cl 和37C1组成的氯气中所含质子数一定为17NA
B. 7.8 g Na2O2与足量酸性KMnO4溶液反应,转移的电子数为0.2NA
C. 密闭容器中1mol PCl3与1 mol Cl2反应制备PCl5(g),增加了2NA个P-Cl键
D. 5.6g铁片投入足量浓硝酸中,转移的电子数为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com