
【题目】天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是

A. 当0<V≤33.6 L时,负极反应式为CH4+10OH--8e-== CO32-+7H2O
B. 正极反应式为O2 +4H+ +4e-==2H2O
C. 当V=67.2 L时,电池总反应方程式可写为CH4+2O2+NaOH== NaHCO3+2H2O
D. 电解质溶液中的Na+向正极移动
【答案】B
【解析】
燃料电池中,通入燃料的一端为原电池的负极,通入空气的一端为原电池的正极,n(NaOH)=1.5mol/L×2L=3mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2NaOH=Na2CO3+H2O、③Na2CO3+CO2+H2O=2NaHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应。
A、当0<V≤33.6L时,0<n(CH4)≤1.5mol,则0<n(CO2)≤1.5mol,只发生反应①②,且NaOH过量,则电池总反应式为CH4+2O2+2NaOH=Na2CO3+3H2O,负极反应式为CH4+10OH--8e-== CO32-+7H2O,故选项A正确;
B、碱性燃料电池,正极反应式为2H2O +O2 +4e-=4OH-,故选项B错误;
C、当V=67.2L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为CH4+2O2+NaOH=NaHCO3+2H2O,故选项C正确;
D、燃料电池中,通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,Na+向正极移动,故选项D正确。
正确答案选B。


科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式为CH3CH(CH3)CH(C2H5)2。
(1)该烷烃的名称是____________________。
(2)该烷烃可用不饱和烃与足量氢气反应得到。若不饱和烃为烯烃A,则烯烃的结构简式可能有________种。
(3)有一种烷烃C与上述烷烃是同分异构体,它却不能由任何烯烃催化加氢得到。则C的结构简式为______________。与氯气发生取代反应所得一氯代物有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:

①按图所示将实验装置连接好;
②在 U 形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是__________;
(2)实验中观察到的现象是___________;
(3)则1mol Ca(OH)2 能量_______1mol CaO与1molH2O的总能量;(填“大于”,“等于”或“小于”) ;
(4)若该实验中 CaO 换成 NaOH,实验还能否观察到相同现象?_______(填“能” 或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
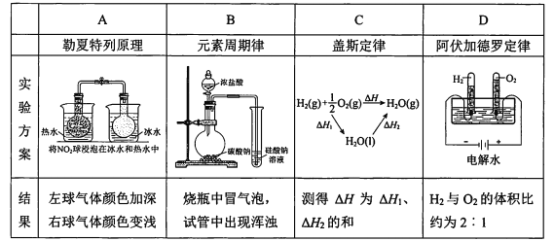
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填编号)。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________________________________。
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全( 使Cu2+浓度降 至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既不属于氧化还原反应,又是吸热反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)28H2O与NH4Cl的反应
C. 生石灰与水反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是________;
(2)既发生离子键破坏、又发生共价键破坏的是______________;
(3)Na2O2的电子式为________;
(4)用电子式表示MgCl2的形成过程 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
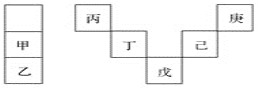
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com