
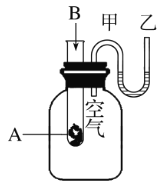
【题目】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:

①按图所示将实验装置连接好;
②在 U 形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是__________;
(2)实验中观察到的现象是___________;
(3)则1mol Ca(OH)2 能量_______1mol CaO与1molH2O的总能量;(填“大于”,“等于”或“小于”) ;
(4)若该实验中 CaO 换成 NaOH,实验还能否观察到相同现象?_______(填“能” 或“否”)。
【答案】检查装置气密性 U形管里的液体左边下降,右边上升 小于 能
【解析】
(1)气体具有热胀冷缩的性质,根据U形管左右两侧液面的变化判断装置内压强的变化,装置密封性要好;
(2)氧化钙和水之间的反应是放热的,空气受热膨胀,内部压强增大;
(3)反应放出热量,反应物具有的总能量大于生成物的总能量;
(4)氢氧化钠和水混合后会有明显的热效应。
(1)气体具有热胀冷缩的性质,根据U形管左右两侧液面的变化判断装置内压强的变化,装置密封性要好,所以实验之前一定要检查装置气密性;
(2)CaO和水反应生成Ca(OH)2的反应是放热反应,反应放出的热量使大试管中空气膨胀,内部压强增大,U形玻璃管里的红墨水(或品红)会沿开口端上升;
(3)CaO和水反应生成氢氧化钙,反应的化学反应方程式为:CaO+H2O=Ca(OH)2,该反应放出热量,说明反应物的能量比生成物的能量高,即1 mol CaO和1 molH2O的能量和大于1 mol Ca(OH)2的能量;
(4)氢氧化钠和水混合后,放出大量的热量,有明显的热效应,因此若该实验中CaO换成 NaOH,实验也能观察到相同现象。


科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)用电子式表示元素④与⑥的化合物的形成过程________________________________,该化合物属于___________(填“共价”或“离子”)化合物.
(2)在这些元素中,化学性质最不活泼的是__________(填具体元素符号,下同),原子结构示意图为____________.元素⑩在周期表中的位置_____________.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______________.
(4)元素①与⑦的化合物是由__________(填“极性”、“非极性”)键形成的.
(5)③与⑥的气态氢化物稳定性强的是________、沸点低的是______________(填分子式)
(6)③⑥⑦三种元素形成的离子半径由大到小的顺序是__________________(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L–1 r溶液的H+的浓度也是0.01 mol·L–1,s通常是难溶于水的有机混合物。上述物质的转化关系如图所示。下列说法正确的是( )
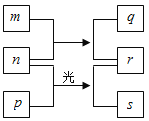
A. 原子半径的大小W<X<YB. 元素的非金属性Z>X>Y
C. Z的氧化物的水化物为强酸D. Y的氢化物常温常压下为液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在过量纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族,B、C、D、E同周期,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,C是地壳中含量最高的金属元素。短周期中,B原子半径最大,E的最高价氧化物对应水化物酸性最强。
(1)E的最高价氧化物对应的水化物的分子式为________________;
(2)D与E可形成分子式为D2E2的物质,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。则D2E2的结构式为______________;
(3)B、C、D、E、A简单离子半径由大到小的顺序为_______________(用离子符号表示)
(4)用电子式表示化合物甲的形成过程________;
(5)C元素的单质能与B元素的最高价氧化物的水化物发生反应,写出该反应离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是( )
(“→”表示一步完成)的关系相互转化的是( )
选项 | a | b | c |
A | Fe | FeCl2 | FeCl3 |
B | Si | SiO2 | SiF4 |
C | HNO3 | NO | NO2 |
D | Al | Al2O3 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是

A. 当0<V≤33.6 L时,负极反应式为CH4+10OH--8e-== CO32-+7H2O
B. 正极反应式为O2 +4H+ +4e-==2H2O
C. 当V=67.2 L时,电池总反应方程式可写为CH4+2O2+NaOH== NaHCO3+2H2O
D. 电解质溶液中的Na+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com