
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族,B、C、D、E同周期,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,C是地壳中含量最高的金属元素。短周期中,B原子半径最大,E的最高价氧化物对应水化物酸性最强。
(1)E的最高价氧化物对应的水化物的分子式为________________;
(2)D与E可形成分子式为D2E2的物质,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。则D2E2的结构式为______________;
(3)B、C、D、E、A简单离子半径由大到小的顺序为_______________(用离子符号表示)
(4)用电子式表示化合物甲的形成过程________;
(5)C元素的单质能与B元素的最高价氧化物的水化物发生反应,写出该反应离子方程式_________。
【答案】HClO4 Cl-S-S-Cl S2->Cl->O2->Na+>Al3+ ![]() 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
A、B、C、D、E都是短周期元素,原子序数依次增大,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则甲为Na2O、乙为Na2O2,A是O元素,B是Na元素;B、C、D、E同周期,A、D同主族,则D为S元素,C是地壳中含量最高的金属元素,则C为Al元素,E的最高价氧化物对应的水化物是最强的含氧酸,则E是Cl元素。然后进行分析解答。
根据上述分析可知A是O元素,B是Na元素,C为Al元素,D为S元素,E是Cl元素。离子化合物甲和乙分别是Na2O、Na2O2。
(1)E的最高价氧化物对应的水化物是高氯酸,分子式是HClO4;
(2)D与E可形成分子式为D2E2的物质S2Cl2,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。在该物质分子中两个S原子形成一个共价键,每个S原子再与Cl原子形成一个共价键,从而使每个原子都达到最外层8个电子的稳定结构,因此D2E2的结构式为Cl-S-S-Cl;
(3) A、B、C、D、E的离子分别是O2-、Na+、Al3+、S2-、Cl-。O2-、Na+、Al3+核外电子排布是2、8,S2-、Cl-核外电子排布是2、8、8,对于电子层结构相同的离子来说,核电荷数越大离子半径越小;对于电子层结构不同的离子来说,离子核外电子层数越多,离子半径越大,因此这些元素的简单离子半径由大到小的顺序为S2->Cl->O2->Na+>Al3+;
(4)化合物甲是Na2O,Na原子失去电子,变为Na+,O原子获得2个电子形成O2-,2个Na+与1个O2-通过离子键结合,用电子式表示化合物甲的形成过程为![]() ;
;
(5)C元素的单质Al能与B元素的最高价氧化物的水化物NaOH溶液发生反应,产生偏铝酸钠和氢气,该反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为______________________。
②Y电极上的电极反应式为_________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是________________,电极反应式为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:

(1)若B能发生银镜反应,请回答下列问题:
①试确定有机物甲的结构简式:__________________;
②用化学方程式表示下列转化过程:
甲+NaOH![]() ________________________________________________________;
________________________________________________________;
B+Ag(NH3)2OH―→_______________________________________________________。
(2)若B不能发生银镜反应,请回答下列问题:
①试确定A的结构简式:_______________________________________________________。
②用化学方程式表示下列转化过程:
甲+NaOH![]() __________________________________________________;
__________________________________________________;
A―→B:_________________________________________________;
D―→E:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:

①按图所示将实验装置连接好;
②在 U 形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是__________;
(2)实验中观察到的现象是___________;
(3)则1mol Ca(OH)2 能量_______1mol CaO与1molH2O的总能量;(填“大于”,“等于”或“小于”) ;
(4)若该实验中 CaO 换成 NaOH,实验还能否观察到相同现象?_______(填“能” 或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
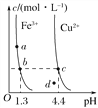
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
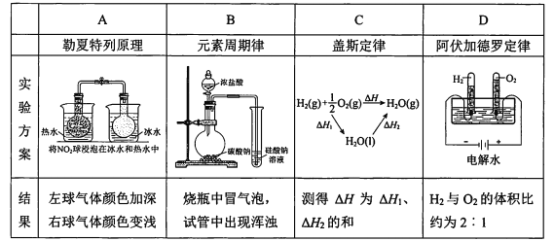
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既不属于氧化还原反应,又是吸热反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)28H2O与NH4Cl的反应
C. 生石灰与水反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
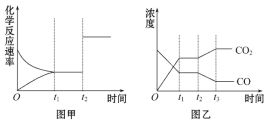
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com