
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填编号)。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________________________________。
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全( 使Cu2+浓度降 至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为________。
【答案】K=![]() 减小增大CO32-DAC2Cl2+CO32-+H2O===CO2↑+2Cl-+2HClO56
减小增大CO32-DAC2Cl2+CO32-+H2O===CO2↑+2Cl-+2HClO56
【解析】
(1)①该反应平衡常数的表达式K=![]() ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大,故答案为:①K=
;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大,故答案为:①K=![]() 、②减小、增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO
、②减小、增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO![]() 与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO
与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO![]() ;②由表中数据可酸性强弱为:CH3COOH>H2CO3>HClO>HCN,因HCN的酸性最弱,加水稀释时电离子程度增大,pH变化最小;③发生反应时应该是较强的酸制取较弱的酸,在反应C中生成的应该为NaHCO3,故不成立;④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO
;②由表中数据可酸性强弱为:CH3COOH>H2CO3>HClO>HCN,因HCN的酸性最弱,加水稀释时电离子程度增大,pH变化最小;③发生反应时应该是较强的酸制取较弱的酸,在反应C中生成的应该为NaHCO3,故不成立;④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO![]() +H2O===CO2↑+2Cl-+2HClO,故答案为:①CO32-②D、A③C④2Cl2+CO
+H2O===CO2↑+2Cl-+2HClO,故答案为:①CO32-②D、A③C④2Cl2+CO![]() +H2O===CO2↑+2Cl-+2HClO。(3)[Cu2+]·[OH-]2>Ksp=2×10-20,[OH-]2>2×10-20÷0.02 mol2·L-2=1×10-18mol2·L-2,[OH-]>1×10-9 mol·L-1;所以pH>5;[Cu2+]= 0.2 mol·L-1÷1 000=2×10-4mol·L-1,则 [OH-]2=2×10-20÷2×10-4mol2·L-2=1×10-16 mol2·L-2,所以 [OH-]=1×10-8 mol·L-1,pH=6;故答案为: 5、6。
+H2O===CO2↑+2Cl-+2HClO。(3)[Cu2+]·[OH-]2>Ksp=2×10-20,[OH-]2>2×10-20÷0.02 mol2·L-2=1×10-18mol2·L-2,[OH-]>1×10-9 mol·L-1;所以pH>5;[Cu2+]= 0.2 mol·L-1÷1 000=2×10-4mol·L-1,则 [OH-]2=2×10-20÷2×10-4mol2·L-2=1×10-16 mol2·L-2,所以 [OH-]=1×10-8 mol·L-1,pH=6;故答案为: 5、6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
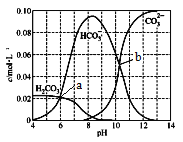
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在过量纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是( )
(“→”表示一步完成)的关系相互转化的是( )
选项 | a | b | c |
A | Fe | FeCl2 | FeCl3 |
B | Si | SiO2 | SiF4 |
C | HNO3 | NO | NO2 |
D | Al | Al2O3 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI![]() H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
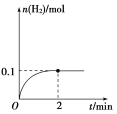
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是

A. 当0<V≤33.6 L时,负极反应式为CH4+10OH--8e-== CO32-+7H2O
B. 正极反应式为O2 +4H+ +4e-==2H2O
C. 当V=67.2 L时,电池总反应方程式可写为CH4+2O2+NaOH== NaHCO3+2H2O
D. 电解质溶液中的Na+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。
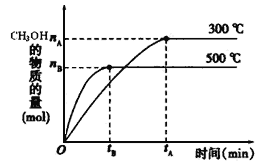
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)___________________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com