
【题目】下列物质可用于干燥氨气的是( )
A.浓硫酸B.碱石灰C.过氧化钠D.活性炭
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
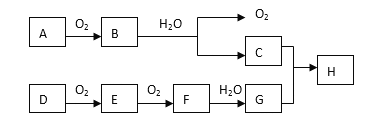
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填编号)。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________________________________。
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全( 使Cu2+浓度降 至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A(s)+3B(g)=2C(g)+2D(g),在不同条件下测得反应速率,其中最快的是
A. υ(C)=0.3 mol/(L·s)B. υ(D)=0.35 mo/l(L·s)
C. υ(B)=0.6 mol/(L·s)D. υ(A)=0.3 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是________;
(2)既发生离子键破坏、又发生共价键破坏的是______________;
(3)Na2O2的电子式为________;
(4)用电子式表示MgCl2的形成过程 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1;
C(s) +CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②下列关于该反应的说法正确的是______________(填选项字母,下同)
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.温度一定时,压强不再随时间变化可以说明反应达到了平衡状态
D.使用高效催化剂,ΔH会增大
③300 ℃时,前10 min内,该反应的平均反应速率为v(H2)=___mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________。
A. 充入CO气体 B. 升高温度
C. 使用优质催化剂 D. 往容器中再充入1 mol CO和2 mol H2
⑤500 ℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向___(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。当乙酸的生成速率主要取决于温度时,其影响范围是__________________。
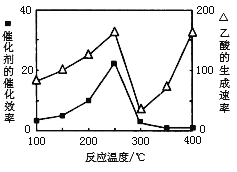
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe3+、Cl-、I-、![]() 、
、![]() ,某兴趣小组进行以下实验:(1)取少量该溶液加入过量硝酸钡溶液后过滤得白色沉淀和滤液(2)向上述白色沉淀中加入足量稀HNO3,发现沉淀完全溶解(3)向(1)中所得滤液中加入足量盐酸,发现溶液变黄色,下列叙述正确的是
,某兴趣小组进行以下实验:(1)取少量该溶液加入过量硝酸钡溶液后过滤得白色沉淀和滤液(2)向上述白色沉淀中加入足量稀HNO3,发现沉淀完全溶解(3)向(1)中所得滤液中加入足量盐酸,发现溶液变黄色,下列叙述正确的是
A. 原溶液中可能含有Na+、![]()
B. 由(3)推断原溶液中存在Fe3+
C. 原溶液中一定有I、![]() 、Na+
、Na+
D. 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com