
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
【答案】2CO(g) + O2 (g) = CO2(g) △H=-566 kJ/mol 0.003mol/(L![]() min) 0.56 减小CO2的浓度 AD 2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ SO2+2H2O-2e-=SO42-+4H+ 2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-
min) 0.56 减小CO2的浓度 AD 2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ SO2+2H2O-2e-=SO42-+4H+ 2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-
【解析】
(1)由①CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
②2H2 (g) + O2 (g) = 2H2O (g) △H=-484 kJ/mol,
根据盖斯定律,①![]() 2+②可得:2CO(g) + O2 (g)= CO2(g);
2+②可得:2CO(g) + O2 (g)= CO2(g);
(2)①根据速率公式计算速率;通过表中数据可以知道,反应进行到20-30分钟时达到平衡状态,则K=![]() ;
;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡;
(3) SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根;
(4)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,同SO2的电极为负极发生氧化反应,书写电极反应式按照先总后分的顺序,先写出总的原电池方程式,然后写出正极的电极反应式,用总方程式减去正极反应式就是负极的电极反应式。
(1)由①CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
②2H2 (g) + O2 (g) = 2H2O (g) △H=-484 kJ/mol,
根据盖斯定律,①![]() 2+②可得:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
2+②可得:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
因此,本题正确答案是:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
(2)①![]() =
=![]() =
=![]() =0.003mol/(L
=0.003mol/(L![]() min);
min);
反应进行到20-30分钟时达到平衡状态,则K=![]() =
=![]() =0.56;
=0.56;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡,故A正确;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡,故B错误;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡,故C错误;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡,故D正确;
因此,本题正确答案是:0.003mol/(L.min); 0.56;减小CO2的浓度
(3) SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
因此,本题正确答案是:2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
(4)原电池总方程式为2SO2+O2+2H2O=2H2SO4,正极的电极反应式为O2+4H++4e-=2H2O,用总的减去正极的电极反应式得负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
因此,本题正确答案是:SO2+2H2O-2e-=SO42-+4H+;2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-。


科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式__________________________________________。
(2)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。
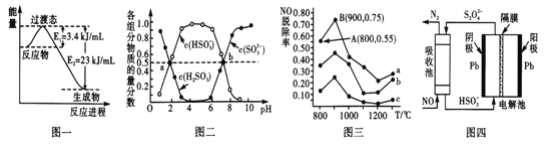
请写出a点时n(HSO3-):n(H2SO3)=_____,b点时溶液pH=7,则n(NH4+):n(HSO3-)=_____。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________。
② 曲线c对应NH3与NO的物质的量之比是______。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性,加入HSO3-,出来S2O42-):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmLAl2(SO4)3溶液中含Al3+ag,取0.2VmL溶液稀释到5Vml,则稀释后溶液中SO42-的物质的量浓度是
A. 125a/(9V)mol·L-1 B. 125a/(18V)mol·L-1
C. 20a/(9V)mol·L-1 D. 20a/(18V)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:(已知:FeS2与H2SO4不反应)

(1)莫尔盐属于____________。
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
(3)加H2SO4酸浸,发生反应的离子方程式为________________________________。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:_________________________________。
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,_______________证明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于铵盐的描述都正确的是( )
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使湿润的红色石蕊试纸变蓝
A.全部
B.①②⑤⑥
C.①②⑤
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
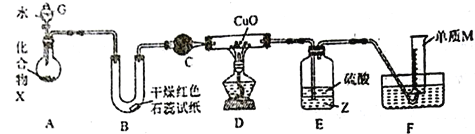
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学--选修五:有机化学)
芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:

(1) C的结构简式是__________________,
(2) E中含氧官能团的名称是___________;C→F的反应类型是___________。
(3) 写出下列化学方程式:G在一定条件下合成H的反应________________________。
(4) D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③能与NaOH溶液发生反应但不属于水解反应
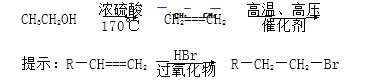
(5)请设计合理方案由 合成
合成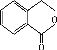 (无机试剂任选,用反应流程图表示,并注明反应条件)。例如:由乙醇合成聚乙烯的反应流程图可表示为____________________
(无机试剂任选,用反应流程图表示,并注明反应条件)。例如:由乙醇合成聚乙烯的反应流程图可表示为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() ,下列关于该物质的说法中正确的是
,下列关于该物质的说法中正确的是
A. 该物质在NaOH的醇溶液中加热可转化为醇类
B. 该物质能和AgNO3溶液反应产生AgBr沉淀
C. 该物质可与溴的四氯化碳溶液发生加成反应
D. 该物质可以发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O中,下列说法正确的是( )
A. 氧化产物与还原产物物质的量之比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的![]()
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全发生还原反应和氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com