
【题目】VmLAl2(SO4)3溶液中含Al3+ag,取0.2VmL溶液稀释到5Vml,则稀释后溶液中SO42-的物质的量浓度是
A. 125a/(9V)mol·L-1 B. 125a/(18V)mol·L-1
C. 20a/(9V)mol·L-1 D. 20a/(18V)mol·L-1
【答案】C
【解析】
根据n=m/M 计算出铝离子的物质的量,再根据硫酸铝的化学式组成计算出硫酸根离子的物质的量,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中硫酸根离子的浓度。
A.ag铝离子的物质的量为:n(A13+ )=ag/27g.mol-1=a/27mol,根据Al2(SO4)3 可知,VmL该硫酸铝溶液中含有硫酸根离子的物质的量为:a/27mol×3/2=a/18mol,原溶液中硫酸根离子浓度为:c(SO42-)=1000a/18V mol.L-1, n=0.2V×10-3L×1000a/18Vmol.L-1=2a×10-1/18mol,稀释后溶液中SO42-的物质的量浓度是C=n/v=2a×10-1/18mol![]() 5V×10-3L= 20a/(9V)mol·L-1,所以答案为:C。
5V×10-3L= 20a/(9V)mol·L-1,所以答案为:C。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子是( )
A. K+、H+、SO32-、S2- B. NH4+、K+、OH-、Cl-
C. H+、K+、MnO4-、SO42- D. Fe3+、Na+、S2-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述正确的是
A. 中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL
B. 用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C. 用量筒量取5.00mL1.00mol·L-1 盐酸
D. 中和滴定实验中的锥形瓶用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转。结构简式为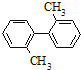 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )
A. 分子中最多有16个原子处于同一平面上
B. 该烃的一氯代物最多有4种
C. 该烃是苯的同系物
D. 分子中至少有9个碳原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有过氧化物存在的条件下,不对称烯烃与HBr加成的反应规律是溴原子加在含氢较多的碳原子上,如: CH3—CH=CH2 + HBr![]() CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
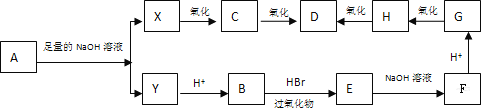
已知:A分子中不含甲基,试回答下列问题:
(1)写出下列物质的结构简式:Y____________、D___________。
(2)写出下列反应的化学方程式:
①A和足量NaOH溶液共热________________________________________;
②B→E ______________________________________________________________;
③X→C ______________________________________________________________;
④X与D发生缩聚反应:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是
A. 过量的铜与浓HNO3 B. 过量的浓盐酸与二氧化锰
C. 过量的铜与浓硫酸 D. 过量的锌与18 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com