
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:
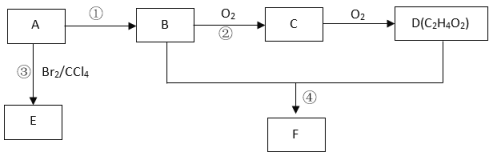
(1)A的结构式为__________________,B中官能团的电子式为______________________, D中官能团的名称为_________________。
(2)反应①的反应类型是_________,反应③的化学方程式为_____________________。
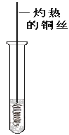
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是_________________。该反应的化学方程式为___________。
(4)D与碳酸氢钠溶液反应的离子方程式为_____________。
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:

试管1中装药品的顺序为先取__________(填“B”、“D”、“浓硫酸”,下同),再加入_______________,最后加入____________。图中X的化学式为___,其作用是____________________________。浓硫酸的作用是_________________________。该反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI![]() H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
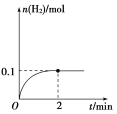
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应生成一种无氧酸和两种氮的常见氧化物。亚硝酰氯应用广泛,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟制备原料气NO和Cl2,制备装置如图所示,为制备纯净干燥的气体,补充右表中缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
蒸馏烧瓶中 | A仪器中 | ||
制备纯净的Cl2 | MnO2 | ①______ | ②______ |
制备纯净的NO | Cu | ③______ | ④______ |
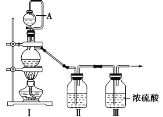
(2)乙组同学对甲组同学制取NO的装置略加改良,结合甲组制得的Cl2共同制备NOCl,装置如图所示:
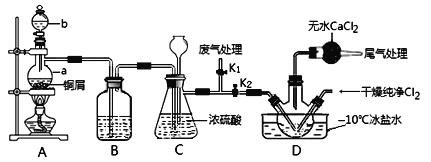
①仪器b的名称为________________。
②组装好实验装置后应先______________,然后依次装入药品。此实验关键操作有两点:一是将Cl2充满D装置的三颈瓶中;二是A中反应开始时要先关闭K2,打开K1,待NO充满装置后再关闭K1,打开K2。这两步操作中充满的目的都是__________________________________________________。
③若C装置中压强过大,可以观察到的现象是_________________________。
④装置D中冰盐水的作用是__________________。
(3)亚硝酰氯(NOCl)纯度的测定:将所得亚硝酰氯(NOCl)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)与水反应的化学方程式为_________________________。
②亚硝酰氯(NOCl)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g),反应过程如下图所示,下列说法正确的是
2NH3(g),反应过程如下图所示,下列说法正确的是
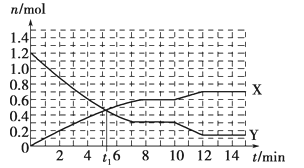
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com