
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应生成一种无氧酸和两种氮的常见氧化物。亚硝酰氯应用广泛,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
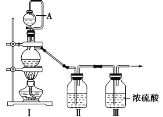
(1)甲组同学拟制备原料气NO和Cl2,制备装置如图所示,为制备纯净干燥的气体,补充右表中缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
蒸馏烧瓶中 | A仪器中 | ||
制备纯净的Cl2 | MnO2 | ①______ | ②______ |
制备纯净的NO | Cu | ③______ | ④______ |
(2)乙组同学对甲组同学制取NO的装置略加改良,结合甲组制得的Cl2共同制备NOCl,装置如图所示:
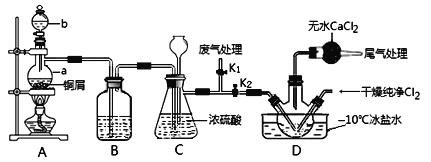
①仪器b的名称为________________。
②组装好实验装置后应先______________,然后依次装入药品。此实验关键操作有两点:一是将Cl2充满D装置的三颈瓶中;二是A中反应开始时要先关闭K2,打开K1,待NO充满装置后再关闭K1,打开K2。这两步操作中充满的目的都是__________________________________________________。
③若C装置中压强过大,可以观察到的现象是_________________________。
④装置D中冰盐水的作用是__________________。
(3)亚硝酰氯(NOCl)纯度的测定:将所得亚硝酰氯(NOCl)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)与水反应的化学方程式为_________________________。
②亚硝酰氯(NOCl)的质量分数为______________________。
【答案】浓盐酸 饱和食盐水或饱和NaCl溶液 稀硝酸 蒸馏水或水 分液漏斗 检查装置的气密性 排尽装置中的空气 长颈漏斗中的液面上升 液化亚硝酰氯,便于收集产品 2NOCl+H2O=2HCl+ NO↑+NO2↑ 90. 0%
【解析】
用二氧化锰和浓盐酸在加热条件下制得氯气,氯气中含有氯化氢,用饱和食盐水除去氯化氢,铜和稀硝酸在加热条件下生成一氧化氮,制得的一氧化氮中可能含有二氧化氮和硝酸蒸气,所以用水除去杂质气,然后再用浓硫酸进行干燥,通入三颈瓶中与干燥的纯净的氯气反应生成产物亚硝酰氯。
(1)用浓盐酸和二氧化锰制取氯气,用饱和食盐水或饱和NaCl溶液除去氯气中的氯化氢气体。用稀硝酸和铜反应生成一氧化氮,用蒸馏水或水除去一氧化氮中的二氧化氮气体和HNO3蒸气。
(2) ①仪器b的名称为分液漏斗;
②组装好实验装置后应先检查装置的气密性,再装入药品。因为亚硝酰氯遇水易反应生成一种无氧酸和两种氮的常见氧化物,所以操作中要排尽装置中的空气。
③若C装置中压强过大,则气体会将液体压入长颈漏斗,会使长颈漏斗中的液面上升。
④装置D中冰盐水可以将亚硝酰氯液化,便于收集产品。
(3) ①亚硝酰氯遇水易反应生成一种无氧酸和两种氮的常见氧化物,即生成氯化氢和一氧化氮和二氧化氮,方程式为:2NOCl+H2O=2HCl+ NO↑+NO2↑;
②根据氯化氢和硝酸银的关系分析,25.00mL溶液中HCl的浓度为![]() =0.72mol/L,则亚硝酰氯(NOCl)的质量分数
=0.72mol/L,则亚硝酰氯(NOCl)的质量分数![]() = 90. 0%。
= 90. 0%。


科目:高中化学 来源: 题型:
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
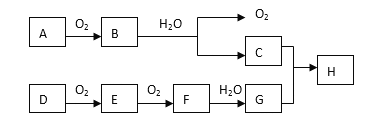
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1;
C(s) +CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②下列关于该反应的说法正确的是______________(填选项字母,下同)
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.温度一定时,压强不再随时间变化可以说明反应达到了平衡状态
D.使用高效催化剂,ΔH会增大
③300 ℃时,前10 min内,该反应的平均反应速率为v(H2)=___mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________。
A. 充入CO气体 B. 升高温度
C. 使用优质催化剂 D. 往容器中再充入1 mol CO和2 mol H2
⑤500 ℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向___(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
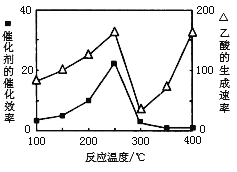
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。当乙酸的生成速率主要取决于温度时,其影响范围是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图点滴板上四个溶液间反应对应的离子方程式书写正确的是
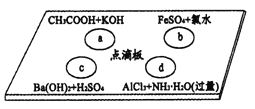
A. a反应:H++OH-![]() H2O
H2O
B. b反应:Fe2++Cl2![]() Fe3++2Cl-
Fe3++2Cl-
C. c反应:Ba2++![]() +H++OH-
+H++OH-![]() BaSO4↓+H2O
BaSO4↓+H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe3+、Cl-、I-、![]() 、
、![]() ,某兴趣小组进行以下实验:(1)取少量该溶液加入过量硝酸钡溶液后过滤得白色沉淀和滤液(2)向上述白色沉淀中加入足量稀HNO3,发现沉淀完全溶解(3)向(1)中所得滤液中加入足量盐酸,发现溶液变黄色,下列叙述正确的是
,某兴趣小组进行以下实验:(1)取少量该溶液加入过量硝酸钡溶液后过滤得白色沉淀和滤液(2)向上述白色沉淀中加入足量稀HNO3,发现沉淀完全溶解(3)向(1)中所得滤液中加入足量盐酸,发现溶液变黄色,下列叙述正确的是
A. 原溶液中可能含有Na+、![]()
B. 由(3)推断原溶液中存在Fe3+
C. 原溶液中一定有I、![]() 、Na+
、Na+
D. 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为V L的恒容容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的总的物质的量没有变化。请回答:
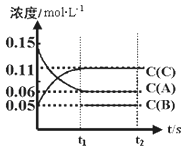
(1)V =_________。
(2)若t1=15s时,则0-t1阶段以C物质浓度变化表示的反应速率v(C)=__________。
(3)写出反应的化学方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com