
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI![]() H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
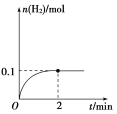
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
【答案】c0.1 mol·L-1·min-164b向右b
【解析】
(1)反应Ⅲ在常温下向左进行,故a项错误,;SO2的还原性比HI强,故b项错误;根据盖斯定律Ⅰ×2+Ⅱ×2+Ⅲ得总反应:2H2O===2H2+O2,循环过程中消耗了H2O ,故c项正确;根据总反应知产生1 mol O2的同时产生2 mol H2,故d项错误;答案选C。(2)由题干数据分析该反应:
0~2 min内平均反应速率v(HI)=![]() =0.1 mol·L-1·min-1,
=0.1 mol·L-1·min-1,
平衡常数K=![]() =64,若开始加入HI的物质的量是原来的2倍,相当于先将HI加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为等体积反应,加压平衡不移动,所以HI的浓度为原来的2倍,H2的体积分数不变,温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短;故答案为:0.1 mol·L-1·min-1、64、b;(3)Zn与稀H2SO4反应,c(H+)减小,水的电离平衡向右移动;若向原溶液中加入NaNO3,Zn与H+、NO
=64,若开始加入HI的物质的量是原来的2倍,相当于先将HI加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为等体积反应,加压平衡不移动,所以HI的浓度为原来的2倍,H2的体积分数不变,温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短;故答案为:0.1 mol·L-1·min-1、64、b;(3)Zn与稀H2SO4反应,c(H+)减小,水的电离平衡向右移动;若向原溶液中加入NaNO3,Zn与H+、NO![]() 反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO
反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO![]() 消耗H+生成H2O和SO2,反应速率减小;故答案为:向右、b。
消耗H+生成H2O和SO2,反应速率减小;故答案为:向右、b。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】有①②③三瓶体积相等,浓度都是1 mol/L的HCl溶液,将①加热蒸发体积至体积减少一半,在②中加入少量CH3COONa固体,加入后溶液仍呈强酸性,③不作改变。然后以酚酞做指示剂,用NaOH溶液滴定上述三种溶液,可观察到所消耗的NaOH溶液体积是( )
A.①=③>②B.③>②>①C.③=②>①D.①=②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)用大理石和100ml某稀盐酸反应制CO2 ,产生CO2的体积与反应时间的关系如图所示,其中产生CO2速率最快的为____段(选填“OE”、“EF”或“FG”),若该段内生成标准状况下的CO2 448mL,所用时间为2min,该段时间内用HCl来表示其反应速率,则速率为_____,(忽略反应后溶液体积的变化),若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
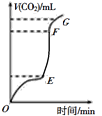
A.将大理石换用碳酸钙粉末 B.加入K2SO4溶液 C.升高温度
D.加入NaCl固体 E.增大盐酸的浓度
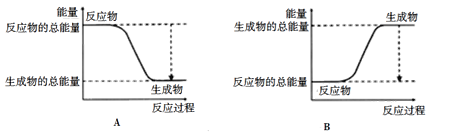
(2)对于反应2A2+B2=2A2B,已知A2、B2、A2B的键能如下表:
化学键 | A-A | B=B | A-B |
键能/kJ/mol | 236 | 406 | 163 |
下图能正确表示该反应过程中能量变化的选项是_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
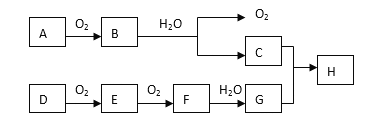
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在农村,有些地区由于使用了没有保护措施的铁制自来水管,导致水中含有Fe3+,用这种水泡的茶,茶水的颜色略带黑色。我们可以在这种水中加入下列哪种溶液使得溶液呈红色来检验Fe3+( )
A.K2SB.KCNC.KSCND.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填编号)。
A.HCN B.HClO
C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________________________________。
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全( 使Cu2+浓度降 至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A(s)+3B(g)=2C(g)+2D(g),在不同条件下测得反应速率,其中最快的是
A. υ(C)=0.3 mol/(L·s)B. υ(D)=0.35 mo/l(L·s)
C. υ(B)=0.6 mol/(L·s)D. υ(A)=0.3 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com