
【题目】用于解释下列现象的化学用语表述正确的是( )
A. 硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 亚硫酸溶液呈酸性:H2SO3===2H++SO32-
C. 氯化铝溶液跟过量的氨水反应:Al3++4OH-===[Al(OH)4]-
D. FeCl3溶液呈酸性:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.煤经过气化和液化等物理变化可转化为清洁能源
B.生石灰和铁粉都是食品包装中常用的干燥剂
C.地沟油没有利用价值,可用燃烧法处理
D.水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径
原子 | N | S | O | Si |
半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:氢氧化钠、金刚石、硫化钾、干冰,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是( )
A.①②②③B.②①②③C.②③②①D.①①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
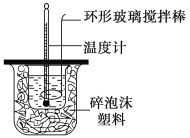
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com