
【题目】碳及其化合物与人类生产、生活密切相关.
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S.
已知:C(s)+ ![]() O2(g)=CO(g)△H1=﹣126.4kJmol﹣1
O2(g)=CO(g)△H1=﹣126.4kJmol﹣1
C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1
S(s)+O2(g)=SO2(g)△H3=﹣296.8kJmol﹣1
则SO2氧化CO的热化学反应方程式为
(2)一种新型CO燃料电池工作原理如图所示.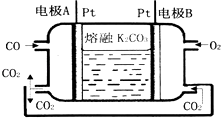
①负极电极反应式:;正极电极反应式: .
②电极A处产生的CO2有部分参与循环利用,其利用率为 .
【答案】
(1)SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJ?mol﹣1
(2)CO+CO32﹣﹣2e﹣=2CO2;O2+4e﹣+2CO2═2CO32﹣;50%
【解析】解:(1)已知:①C(s)+ ![]() O2(g)═CO(g)△H1=﹣126.4kJ/mol②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1③S(s)+O2(g)═SO2(g)△H3=﹣296.8kJmol﹣1依据盖斯定律计算②×2﹣①×2﹣③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;所以答案是:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;
O2(g)═CO(g)△H1=﹣126.4kJ/mol②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1③S(s)+O2(g)═SO2(g)△H3=﹣296.8kJmol﹣1依据盖斯定律计算②×2﹣①×2﹣③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;所以答案是:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=﹣237.4kJmol﹣1;
(2)①负极是一氧化碳发生氧化反应,生成二氧化碳,电极反应式为:CO+CO32﹣﹣2e﹣=2CO2 , 正极电极反应为:O2+4e﹣+2CO2═2CO32﹣ , 所以答案是:CO+CO32﹣﹣2e﹣=2CO2;O2+4e﹣+2CO2═2CO32﹣;
②根据负极2CO+2CO32﹣﹣4e﹣=4CO2 , 而正极反应为O2+4e﹣+2CO2═2CO32﹣ , 所以在转移4mol电子相同的情况下负极产生4mol的二氧化碳,而正极消耗2mol的二氧化碳,所以利用率为50%,所以答案是:50%.


科目:高中化学 来源: 题型:
【题目】下列物质所含分子数最多的是( )
A. 0.5 mol Cl2 B. 标准状况下3.36 L CO
C. 5.6g N2 (N2的摩尔质量为28 g·mol-1) D. 含NA个分子的O2(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( ) 
A.铁棒AB段发生反应为O2+4e﹣+2H2O=4OH﹣
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是( )
A. 在任何条件下,化学平衡常数是一个定值
B. 改变反应物浓度或生成物浓度都会改变平衡常数K
C. 平衡常数K只与温度有关,与反应浓度、压强无关
D. 两种物质反应,不管怎样书写化学方程式,平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是 kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)在直接以甲醇为燃料的电池中,理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能占燃料电池反应所能释放的全部能量的百分比).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子。它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分别制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为___________________、__________________。制得等量H2所需能量较少的是_________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=___________,反应平衡常数K=__________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制取NH3的叙述正确的是( )
A. 用N2和H2作反应物 B. 用无水氯化钙进行干燥
C. 用向上排空气法收集 D. 用蘸有浓盐酸的玻璃棒验满
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com