
 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:分析 A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,结合题目分析解答.
解答 解:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
(1)通过以上分析知,A、B、C、D分别是Na、Na2O2、NaOH、Na2CO3,
故答案为:Na;Na2O2;NaOH;Na2CO3;
(2)B是过氧化钠,能和水、二氧化碳反应生成氧气,所以可以作供氧剂,故答案为:供氧剂;
(3)钠和水反应生成氢氧化钠和氢气,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式分别为2Na+2H2O═2Na++2OH-+H2↑、2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(4)碳酸钠溶解度大于碳酸氢钠,向饱和碳酸钠溶液中通入过量二氧化碳生成碳酸氢钠,导致溶液为过饱和溶液,则有碳酸氢钠晶体析出,故答案为:有白色晶体析出.
点评 本题以钠及其化合物之间的转化为载体考查无机物推断,侧重考查学生分析推断能力,涉及物质推断、离子方程式书写、物质用途等知识点,明确元素化合物的性质及物质之间的转化是解本题关键,注意基础知识的积累.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 |  |  |  |  |
| 实验目的 | 比较非金属性:N>C>Si | 制备并收集乙酸乙酯 | 除去Ca(OH)2中的NH4Cl | 验证HCl的溶解性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 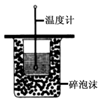 进行中和热的测定 | |
| B. | 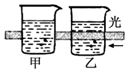 运用该实验可区分胶体和溶液 | |
| C. | 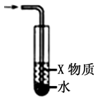 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
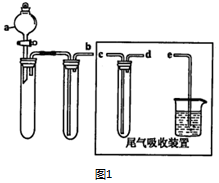
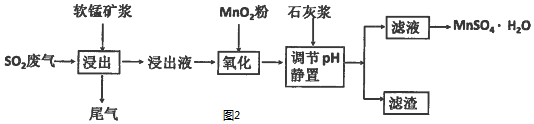
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com