
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
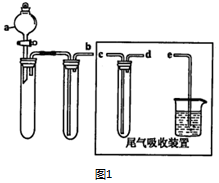
分析 (1)①实验室用Na2SO3 固体与浓硫酸反应制备二氧化硫气体;
②根据装置图分析;
③bc导管连接的试管是用于防倒吸的,所以bd相连,防止液体倒吸进入前面的试管中;
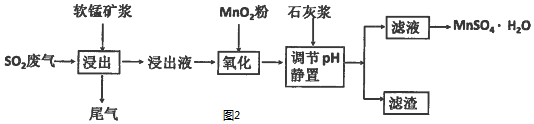
(2)①铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能净水;
②从流程图看,浸出过程是软锰矿浆(MnO2)与SO2的反应.
③杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+;
④从表可以看出,只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀;
⑤Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙.
解答 解:(1)①A.Na2SO3溶液与稀硝酸反应生成硫酸钠,NO和水,不能生成二氧化硫,故A错误;
B.Na2SO3固体与浓硫酸生成二氧化硫,故B正确;
C.固体硫和氧气生成二氧化硫中会混有氧气,而且图中装置不能发生燃烧反应,故C错误;
D.如图所示装置没有加热,则不能用浓硫酸和铜反应制备二氧化硫,故D错误;
故答案为:B;
②由装置图可知,a的仪器名称是分液漏斗;
故答案为:分液漏斗;
③bc导管连接的试管是用于防倒吸的,所以bd相连,防止液体倒吸进入前面的试管中,所以仪器的连接顺序为b-d-c-e;
故答案为:d;c;
(2)①铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能净水,其净水原理为Al3++3H2O?Al(OH)3(胶体)+3H +;
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H +;
②低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应的化学方程式为SO2+MnO2=MnSO4,
故答案为:SO2+MnO2=MnSO4;
③杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:将Fe2+氧化为Fe3+;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
④溶液中加入石灰浆来调节pH,其作用是除去杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可,
故答案为:4.7≤pH≤8.3;
⑤Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙.
故答案为:氢氧化铁、氢氧化铝、硫酸钙.
点评 本题以制备硫酸锰的生产流程为知识载体,考查化学反应的书写、及除杂质的问题、氧化还原反应等,题目难度中等,本题注意把握数据处理能力和流程分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价. |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍. |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态. |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧. |
 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑤⑨ | C. | ④⑤⑥⑦ | D. | ②③⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com