
| A. | ①②⑤ | B. | ②③⑤⑨ | C. | ④⑤⑥⑦ | D. | ②③⑧⑨ |
分析 ①漏掉了铜离子与氢氧根离子生成氢氧化铜的反应;
②钠与水反应生成氢氧化钠和氢气;
③碳酸钙和醋酸都需要保留化学式;
④氟气与水反应生成氟化氢和氧气;
⑤氢氧化钙少量,离子方程式按照氢氧化钙的化学式组成书写;
⑥二氧化碳过量,反应不会生成碳酸钙沉淀;
⑦钠与硫酸铜溶液反应,钠先与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,不会置换出铜;
⑧氯气与水反应生成的次氯酸不能拆开;
⑨纯碱溶液中滴加少量盐酸,反应生成碳酸氢钠.
解答 解:①硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故①错误;
②将金属钠加入水生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故②正确;
③石灰石溶于醋酸,反应的离子方程式为:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O,故③正确;
④氟气与水反应生成氧气和HF,正确的离子方程式为:2F2+2H2O═4H++4F-+O2↑,故④错误;
⑤小苏打溶液中加入少量的石灰水,反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故⑤正确;
⑥次氯酸钙溶液中通入过量二氧化碳,反应生成次氯酸和碳酸氢钙,正确的离子方程式为:ClO-+CO2+H2O═HCO3-+HClO,故⑥错误;
⑦钠先和水反应为氧化还原反应,氧化剂H2O,被氧化的元素Na,氧化产物NaOH,生成NaOH和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,离子反应为2Na+2H2O═2Na++2OH-+H2↑,NaOH与硫酸铜发生复分解反应,反应的化学方程式为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,生成氢氧化铜和硫酸钠,离子反应为Cu2++2OH-=Cu(OH)2↓,总反应为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑,故⑦错误;
⑧氯气与水反应生成次氯酸和氯化氢,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl -+HClO,故⑧错误;
⑨纯碱溶液中滴加少量盐酸,反应生成碳酸氢钠,反应的离子方程式为:CO32-+H+═HCO3-,故⑨正确;
根据分析可知,正确的为②③⑤⑨,
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
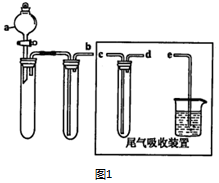
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1 NaAlO2溶液中AlO2-数为0.1NA | |
| B. | 4.48L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 1.2g金刚石所含共价键数为0.2NA | |
| D. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时改变两个变量来研究化学平衡的移动,能更快得出有关规律 | |
| B. | 催化剂通过改变反应历程,降低反应的活化能来加快反应速率 | |
| C. | 可逆反应的平衡向正向移动,该反应的平衡常数一定增大 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$\stackrel{Cl_{2}}{→}$粗SiCl4$→_{(2)H_{2}/高温}^{(1)分馏提纯}$高纯硅 | |
| C. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗Br2$→_{蒸馏}^{NaBr(s)}$Br2 | |
| D. | 铝土矿$→_{(2)过滤}^{(1)NaOH(aq)}$NaAlO2(aq)$→_{(2)过滤}^{(1)CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{煅烧}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4所含的分子数为NA | |
| B. | 1mol的羟基(-OH)与1 mol的氢氧根(OH -)离子所含电子数均为9 NA | |
| C. | 常温常压下,在30g 的乙烷气体分子中,碳氢键的总个数为6NA | |
| D. | 一定条件下,将2molSO2与足量的O2充分反应,生成SO3的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com