
【题目】在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、S2-,在检验方案设计时初步分析其溶液中最多可含离子(只从这8种离子中选择)有( )
A.4种B.5种C.6种D.7种
科目:高中化学 来源: 题型:
【题目】下列物质中,在一定条件下既能进行加成反应,也能进行取代反应,并且不能使KMnO4酸性溶液褪色的是( )
A. 乙烷B. 乙烯C. 乙炔D. 苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20mL 0.01molL﹣l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( ) 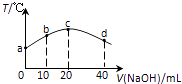
A.HNO2的电离平衡常数:c点>b点
B.b点混合溶液显酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣)
C.c点混合溶液中:c(OH﹣)>c(HNO2)
D.d点混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.1mol/L的 H2SO4溶液980mL,欲用 98%、密度为1.84g/cm3的浓硫酸配制.
(1)所需的主要仪器除量筒、烧杯、玻璃棒外,还需要___________、______________。
(2)其实验操作步骤可分为以下几步:
A.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):_____________________
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视量筒刻度线,会导致所配溶液浓度会_________;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛仰视刻度线,所配溶液浓度会____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广.请回答下列问题
(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示. 
①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因: .
①2O2(g)+N2(g)=N2O4 , (l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=﹣1048.9kJ/mol
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:
N2H4 | N2O4 | |
密度/g/cm3 | 1.004 | 1.44 |
(3)联氨为二元弱減,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;KW=1.0×10﹣14),.联氨与硫酸形成的酸式盐的化学式为 .
(4)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是(填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能使H2OH++OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是( )
A.将水加热到99℃,使水的pH=6.1
B.在水中滴入稀H2SO4
C.在水中加入Na2CO3固体
D.在水中加入氯化铝固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com